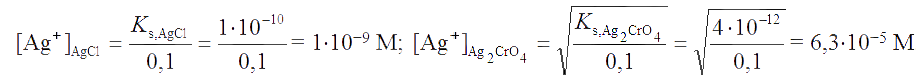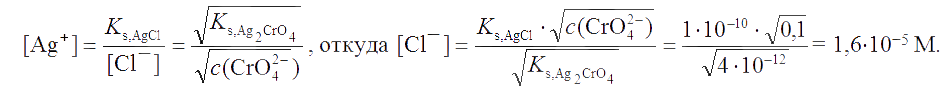Если в растворе одновременно присутствуют несколько веществ, способных осадиться одним реагентом, то осадки будут выпадать по мере достижения произведения растворимости, т.е. сначала выпадет осадок той соли, растворимость которой меньше. При одинаковом стехиометрическом составе соединений, меньшей растворимости соединения отвечает и меньшая величина Ks. В случае малорастворимых соединений различного стехиометрического состава молярную растворимость соединения S рассчитывают из величины Ks по формуле (3.3). Порядок, в котором осаждаются ионы разного сорта, зависит не только от величин произведений растворимости, но также и от исходных концентраций ионов. При определенных концентрационных соотношениях осаждаемых ионов порядок осаждения может быть изменен на обратный, т.е. соединение с большей растворимостью может выпадать первым.
Зная исходные концентрации веществ и произведения растворимости, можно рассчитать как последовательность (пример 38), так и полноту выделения осадков (пример 39).
Решение. В результате смешения растворов начальные концентрации галогенид-ионов будут равны: cCl¯= 0,1 М; cBr¯= 1×10−4 М. Осаждение хлорид-иона начнется при величине
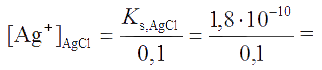
а бромид-иона - при величине 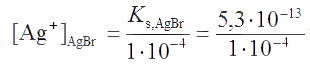
Так как [Ag+]AgCl < [Ag+]AgBr, первым начнет осаждаться AgCl, несмотря на его бóльшую растворимость по сравнению с AgBr.
Решение. Первым будет выпадать осадок, произведение растворимости которого будет достигнуто при меньшей концентрации иона Ag+. Вычисляем, при каких концентрациях этого иона начинают осаждаться AgCl и Ag2CrO4:
Как видно, первым будет выпадать осадок AgCl. Образование осадка Ag2CrO4 начнется тогда, когда концентрация хлорид-иона по мере выделения AgCl снизится и параллельно этому концентрация иона серебра увеличится настолько, что будет достигнуто произведение растворимости Ag2CrO4. При совместном выделении AgCl и Ag2CrO4 концентрация иона серебра равна
Следовательно, осаждение Ag2CrO4 начнется при концентрации хлорид-иона, равной 1,6×10-5 М.