3. Равновесия в гетерогенных системах
3.1. Произведение растворимости
В насыщенном растворе малорастворимого соединения AmBn равновесие AmBn ↔ mA + пВ (зарядовые числа ионов опущены ради простоты) количественно характеризуется в соответствии с ЗДМ константой
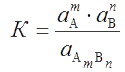 . . |
(3.1) |
Активность твердой фазы aAmBn= const, поэтому K · aAmBn= const и называется термодинамическим произведением растворимости: KS°= K · aAmBn= aAm · aBn.
В контакте с ненасыщенным раствором aAm· aBn< KS° твердая фаза будет растворяться, пока не установится равновесие
| (3.2) |
В пересыщенном растворе aAm · aBn > KS°. Если такой раствор привести в контакт с кристаллами вещества, то начнется немедленное выпадение осадка до тех пор, пока не установится равновесие (3.2). Перепишем уравнение (3.2) с учетом зависимости а = Υ×c:
где KS = [A]m[В]n - концентрационное произведение растворимости.
Произведение растворимости электролита, состоящего из бóльшего числа разноименных ионов, чем бинарный, равно произведению активностей всех его ионов. Например, в случае соединения MgNH4PO4
В насыщенном растворе малорастворимого соединения коэффициенты активностей ΥA и ΥВ близки к 1 (а ≅ с), т.е. KS=KS°.
Пусть растворимость малорастворимого электролита типа АmВп в насыщенном водном растворе равна S моль/л. Тогда молярные концентрации ионов А и В равны: [A] = mS, [B] = nS, а произведение растворимости KS = [A]m[B]n = [mS]m[nS]n = mm · nn · Sm+n. Отсюда получаем уравнение связи растворимости с величиной Ks:
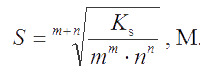 . . |
(3.3) |
Это уравнение и используют для расчета Ks по величине S (пример 29). Зная Ks можно, наоборот, вычислить растворимость S.
Присутствие сильного электролита, не имеющего с осадком одноименного иона, увеличивает растворимость осадка за счет снижения коэффициентов активности ионов в растворе (солевой эффект). Поэтому произведение растворимости должно в этом случае использоваться в термодинамической форме:
откуда
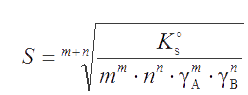 . . |
(3.4) |
Из этого уравнения видно, что с ростом ионной силы I растворимость осадка увеличивается, поскольку коэффициенты активностей ионов уменьшаются.
В присутствии сильного электролита, имеющего общий ион с осадком, его растворимость уменьшается вследствие увеличения концентрации одного из ионов кристаллической решетки осадка, что ведет к неравенству aAm· aBn> KS°. В результате происходит дополнительное выделение твердой фазы из пересыщенного раствора до тех пор, пока не установится гетерогенное равновесие в системе. Солевой эффект за счет присутствия сильного электролита здесь также имеет место, однако фактор подавления растворимости под действием одноименного иона играет доминирующую роль (пример 30).
Решение. Вычисляем молярную растворимость:
100,99 г раствора содержат 0,99/М моль PbCl2
1007 г ---------------- S моль PbCl2.
Из этой пропорции находим:
По данным растворимости вычисляем величину KS°:
Решение. Ионная сила раствора определяется преимущественно ионами сильного электролита: I = ½(0,2 + 0,1 · 22) = 0,3 M. Согласно справочным данным, при I = 0,3 M значения ΥBa2+=ΥSO42- = 0,42. Равновесные концентрации ионов в насыщенном растворе сульфата бария равны: [Ba2+] = S M; [SO42-] = (0,1 + S) M. С учетом этих концентраций и ионной силы раствора KS° сульфата бария выразится в виде
KS° = S · Υ · (0,1 + S) · Υ = 1,1×10-10.
Поскольку отношение с/KS° = 0,1/1,1·10-10 >> 400, то c достаточным приближением можно положить 0,1 + S = 0,1. Тогда получаем простое уравнение S · 0,1 · Υ2 = 1,1 · 10-10, откуда S = 6,24·10-9 M. В отсутствие Na2SO4 величина S = √1.1·10-10 = 1,05·10-5 M.
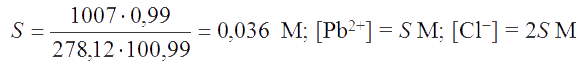
.PNG)