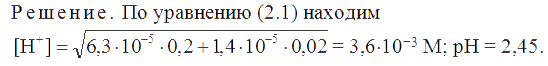Если диссоциация слабого протолита происходит в присутствии сильного электролита, не имеющего общего иона, то необходимо при расчете равновесных концентраций химических форм в растворе в уравнение ЗДМ подставлять активности ионов, а не их концентрации (пример 11). Для нахождения коэффициентов активностей вычисляют ионную силу раствора. Если концентрация слабого электролита сопоставима с концентрацией сильного, то при вычислениях вкладом ионов слабого электролита в ионную силу можно пренебречь.
Для слабого электролита HAn, характеризуемого степенью диссоциации α, ЗДМ с учетом ионной силы раствора примет вид
где γ± – средний коэффициент активности бинарного электролита.
Если Ка ≤ 10-5 и раствор не очень разбавлен, то α << 1, и можно положить 1 - α ≅ 1. В таком случае , откуда
.
Отсюда следует, что чем больше ионная сила раствора, тем меньше γ± и тем больше α, т.е. введение в раствор слабого протолита другого сильного электролита, не имеющего общего иона со слабым, повышает степень диссоциации последнего. Это явление называется солевым эффектом.
Если диссоциация слабого протолита происходит в присутствии сильного электролита, имеющего общий ион со слабым, то на диссоциацию последнего оказывают влияние одновременно два фактора, действующие в противоположном направлении:
1) c одной стороны, добавление сильного электролита повышает ионную силу раствора, что должно усиливать диссоциацию слабого электролита за счет солевого эффекта;
2) c другой стороны, введение в раствор слабого протолита одноименного иона понижает его степень диссоциации. Однако эффект введения одноименного иона доминирует над солевым эффектом и степень диссоциации электролита понижается (пример 12).
Если в растворе присутствуют одновременно два протолита различной силы, то упрощенный расчет можно провести только при условии, что Ka1 > Ka2 (пример 13).
Для смеси не очень слабых кислот НА1 и НА2 равной силы с концентрациями с1 и с2, пренебрегая автопротолизом воды, уравнение электронейтральности раствора можно записать в виде [H+] = [A1-] + [A2-].
Определяя равновесные концентрации частиц А1- и А2- из выражений для констант диссоциации кислот и подставляя их в уравнение электронейтральности, получаем
,
или после преобразования . Отсюда
.
Если степень диссоциации кислот не превышает 5%, то
| (2.1) |
Аналогично для смеси n одноосновных кислот , а для бинарной смеси однокислотных оснований
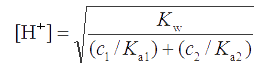
где Ka1 и Ka2- константы диссоциации сопряженных кислот.
Следовательно, если протолиты сопоставимы по силе, то необходимо принимать во внимание диссоциацию обоих протолитов (пример 14).
Пример 11. Вычислить равновесную концентрацию ионов при диссоциации С6Н5СООН в присутствии KCl, если концентрация каждого электролита равна 0,01 М.
Решение. Находим ионную силу раствора, пренебрегая вкладом в нее ионами бензойной кислоты: . Вычисляем коэффициенты активностей:
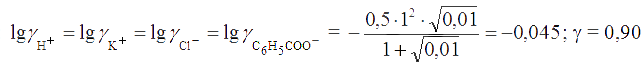
Записываем константу диссоциации бензойной кислоты с учетом ионной силы
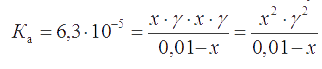
поскольку активность недиссоциированых молекул кислоты равна их концентрации ( γC6H5COOH = 1). Решив квадратное уравнение х2 + 7,8×10-5 х - 7,8×10-7 = 0, находим х = 8,8×10-4 М.
В отсутствие KCl константа диссоциации кислоты выражается уравнением , решением которого является величина х = [H+] = [C6H5COO-] = 7,9×10-4 М. Таким образом, концентрация ионов H+ и C6H5COO- в присутствии КCl возросла в 1,1 раза вследствие увеличения ионной силы раствора.
Пример 12. Вычислить степень диссоциации уксусной кислоты, концентрация которой 0,1 М, в присутствии 0,05 М раствора HCl.
Решение. Сильная хлороводородная кислота, диссоциируя в водном растворе нацело, создает ионную силу I = ½(0,05×12 + 0,05×12) = 0,05. Вычисляя или используя справочные данные, находим: γH+ = 0,86; γAc- = 0,82.
В качестве минимальной концентрации в данном случае следует использовать равновесную концентрацию ацетат-иона, т.е. положить х = [Ac-]. Тогда равновесная концентрация ионов водорода будет складываться из ионов за счет полной диссоциации НCl и частичной диссоциации уксусной кислоты, т.е. выразится как ([H+] + x). Концентрация недиссоциированных молекул уксусной кислоты будет равна: [HAc] = (0,1 - x). Ввиду высокой ионной силы раствора выражение для Ка уксусной кислоты следует записать с учетом коэффициентов активностей ионов:
.PNG)
Допуская, что х << 0,05, имеем: х×0,82×0,05×0,86 = 1,74×10-5×0,1, откуда = 4,97 · 10-5, а степень диссоциации
. В отсутствие НCl α = 1,32 %. Таким образом степень диссоциации уксусной кислоты в 0,05 М растворе НCl уменьшается приблизительно в 26 раз (1,32/0,05 = 26,4).
Пример 13. Вычислить степень диссоциации уксусной кислоты в присутствии дихлоруксусной, если концентрация каждой из них в растворе равна 0,05 М ( KCHCl2COOH= 5×10-2; KCH3COOH= 1,74×10-5).
Пример 14. Рассчитать рН раствора, содержащего 0,2 М бензойную (Ка = 6,3×10-5) и 0,02 М 4-аминобензойную (Ка = 1,4×10-5) кислоты.
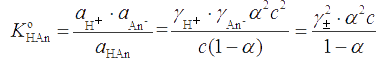
.PNG)