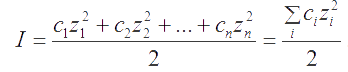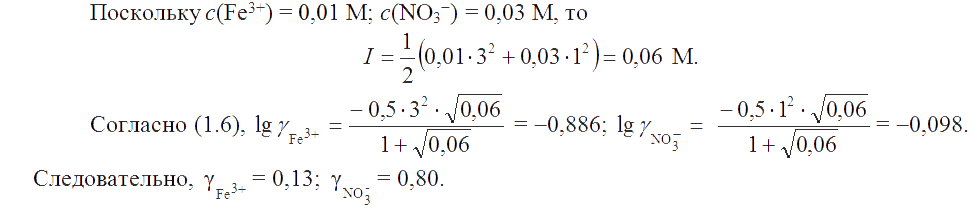Все аналитические реакции в разной степени обратимы. Необходимо находить условия, выбирать реагенты, обеспечивающие смещение равновесия в сторону образования продуктов. Это целесообразно делать расчетным путем на основе закона действия масс с использованием констант равновесий.
Расчеты могут быть осложнены тем, что реакционная способность ионов в растворе (в случае анализа неорганических веществ) зависит от степени их электростатического взаимодействия между собой и другими ионами, присутствующими в данном растворе. Этот эффект называют влиянием ионной силы.
Электростатические взаимодействия проявляются в полярных растворителях, в которых растворенное вещество – электролит − в значительной степени ионизировано. Теория, объясняющая свойства растворов электролитов, была разработана Дебаем и Хюккелем в 1923 г. Согласно этой теории, взаимное влияние электрических полей ионов приводит к тому, что в растворе вокруг каждого свободно движущегося иона группируются, располагаясь симметрично, ионы противоположного знака, образуя ионную атмосферу или ионное облако, замедляющее движение иона в растворе. В результате подвижность ионов уменьшается, вследствие чего они проявляют пониженную химическую активность.
Количественной мерой электростатического взаимодействия между всеми ионами является ионная сила раствора I, равная половине суммы произведений концентраций (с) каждого из присутствующих в растворе ионов на квадрат его зарядового числа (z).
Состояние растворенных частиц в реальном растворе, в отличие от идеального (бесконечно разбавленного) раствора, характеризует величина ‑ активность (а), которую используют вместо концентрации. Степень отклонения активности от концентрации характеризует коэффициент активности (γ). Численно активность равна концентрации, умноженной на коэффициент активности γ:
Коэффициенты активности ионов различного сорта приведены в справочной литературе. Их также можно вычислить, зная I (пример 3). Для электролита АтВп зависимость коэффициента активности индивидуального i-го иона от величины I дается уравнением Дебая–Хюккеля. В случае I ≤ 0,3 М оно имеет вид
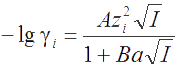 , , |
(1.5) |
где А и В - расчетные коэффициенты Дебая–Хюккеля. Для водных растворов при 25°С они равны: А = 0,51; В = 0,33. Коэффициент а - ионный размерный параметр (ионный радиус), выраженный в Å. Для большинства ионов а ≈ 3 Å, так что величина Ва близка к 1.
Если I ≤ 0,2 М, то
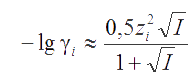 . . |
(1.6) |
Когда I ≤ 0,01 М, то
Для расширения диапазона вариаций ионной силы предложен ряд поправок и эмпирических модификаций уравнения Дебая–Хюккеля. В частности, при I ≤ 1 М используют уравнение Дэвиса:
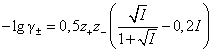
Пример 3. Вычислить ионную силу и коэффициенты активностей ионов в 0,01 M растворе Fe(NO3)3.
Решение.