Важным частным случаем состояния смеси является состояние равновесия, предполагающее установление в системе энергетического, химического, фазового равновесия. Химическое равновесие означает, что состав смеси соответствует определенной температуре и давлению.
Для расчета равновесного состава нужно составить и решить систему уравнений химического равновесия. В большинстве практически интересных случаев необходимо определить равновесный состав при известных (заданных) значениях температуры и давления. Значения всех термодинамических свойств индивидуальных веществ предполагаются известными.
Расчет химического равновесия основан на решении системы уравнений, которые следуют из законов классической термодинамики и условий сохранения вещества.
- Пусть в рассматриваемой термодинамической системе установилось термодинамическое равновесие обратимых реакций диссоциации и рекомбинации. Если равновесие установилось при P=const и T=const, то в этом случае изобарно-изотермический потенциал принимает минимальное значение G=min.
- Уравнения сохранения вещества соответствуют равенству числа атомов химического элемента i в левой и правой частях уравнения условной химической реакции:
топливо↔продукты рекции,
число атомов элемента i в топливе равно числу атомов элемента i в продуктах сгорания.
Обозначим молекулярные продукты реакции символом Mj (j=1,…, l), а атомарные – символом Ai (i=1,…, m). Тогда условная химическая реакция имеет вид:
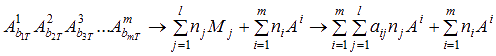 |
(7.3) |
где biT – количество атомов i-го химического элемента; n – число молей; aij – число атомов i-го элемента в j-й компоненте.
Каждую молекулярную компоненту можно представить:
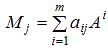
Собирая число атомов при каждом элементе можно записать:
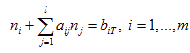 |
(7.4) |
Уравнение (7.4) выражает закон сохранения массы i-го вещества.