К I аналитической группе относятся катионы щелочных металлов - калия K+, натрия Na+, лития Li+ и катион аммония NH4+. Большинство солей катионов I аналитической группы представляют собой белые кристаллические порошки, хорошо растворимые в воде. Вследствие этого катионы данной группы не имеют группового реагента и открывают их только с помощью частных реакций. Перед проведением частных реакций на катионы I аналитической группы ионы других групп удаляют методом осаждения (например, в виде карбонатов в нейтральной или щелочной среде).
Реакция окрашивания пламени.
Летучие соединения лития окрашивают бесцветное пламя горелки в карминово-красный цвет. Реакция весьма чувствительна. Определению мешают ионы натрия. Желтую окраску ионов Na+ маскируют, используя индиговую призму или кобальтовое стекло, не пропускающее желтых лучей.
Методика проведения реакции: С помощью металлической петли из флакона берется небольшое количество соли и вносится в пламя спиртовки.
Результат: пламя окрашивается в карминово-красный цвет.
Реакция с фторидом аммония или калия:
При нагревании смеси выделяется белый аморфный осадок фторида лития, растворимый в уксусной кислоте.
Методика проведения реакции. В пробирку помещают 2-3 капли раствора, содержащего ионы лития, и 2-3 капли раствора фторида аммония или калия. Смесь нагревают до кипения, при этом медленно выделяется белый аморфный осадок. Определению мешают ионы Mg2+, которые можно замаскировать, проводя реакцию в присутствии аммиака при рН 9-10.
Взаимодействие со щелочью:
NH4+ + OH- ↔ NH4OH ↔ NH3 + H2O
При проведении реакции вследствие разложения образующегося гидроксида аммония на аммиак и воду появляется характерный запах аммиака. Выделение аммиака можно зафиксировать с помощью лакмусовой или универсальной индикаторной бумажки, смоченной водой. При выделении аммиака лакмусовая или универсальная индикаторная бумажка синеет.
Методика проведения реакции. В пробирку вносят 5 капель раствора, содержащего ионы аммония, и добавляют 5 капель щелочи. Пробирку слегка подогревают и к верхней части подносят влажную индикаторную бумажку. В присутствии ионов аммония индикаторная бумажка синеет.
Реакция с гидротартратом натрия NaHC4H4O6:
NH4+ + HC4H4O6- = NH4HC4H4O6↓.
Образуется белый кристаллический осадок гидротартрата аммония, растворимый в кислотах и щелочах. Кристаллы имеют характерную форму.
Методика проведения реакции. На предметное стекло наносят капилляром 1-2 капли анализируемого раствора, рядом наносят 1-2 капли гидротартрата натрия. Капли соединяют стеклянной палочкой и перемешивают. Стекло охлаждают и через несколько минут наблюдают в микроскоп форму образовавшихся кристаллов. Определению мешают ионы калия.
Реакция с реактивом Несслера (смесь тетраиодо(II)меркурата калия с гидроксидом калия) K2[HgI4]+KOH:
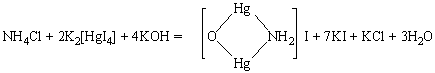
Образуется красно-бурый осадок, растворимый в кислотах и щелочах.
Методика проведения реакции. К одной капле раствора, содержащего ионы аммония, прибавляют 1 каплю реактива Несслера. Реакцию удобнее всего проводить на предметном стеклышке.
Реакция с гексанитро(III)кобальтатом натрия Na3[Co(NO2)6]:
2NH4+ + Na[Co(NO2)6]2- = (NH4)2[Co(NO2)6]↓.
Образуется осадок желтого цвета, растворимый в воде при нагревании.
Методика проведения реакции. В пробирку помещают 3 капли анализируемого раствора, содержащего ионы NH4+, и 3 капли раствора гексанитро(III)кобальтата натрия. После появления осадка проверяют его растворимость в кислотах или щелочах. Определению мешают ионы калия.
Реакция с дегидроантимонатом калия KH2SbO4:
Na+ + KH2SbO4 = NaH2SbO4↓ + K+.
Образуется белый мелкокристаллический осадок дигидроантимоната натрия, растворимый в щелочах и кислотах.
Методика проведения реакции. В пробирку помещают 5 капель раствора, содержащего ионы натрия, и добавляют 5 капель раствора гидротартрата калия. Для ускорения выпадения осадка стенки пробирки потирают стеклянной палочкой. Проведению реакции мешают ионы лития.
Реакция с цинкуранилацетатом HZn(UO2)3(CH3COO)9.9H2O
Na+ + HZn(UO2)3(CH3COO)9 = NaZn(UO2)3(CH3COO)9.
Образуется мелкокристаллический осадок цинкуранилацетата натрия, имеющий характерное строение. Осадок растворим в щелочах и кислотах.
Методика проведения реакции. На предметное стекло наносят каплю раствора, содержащего ионы натрия, и высушивают на плитке. Охлаждают стекло и на место высохшей капли помещают каплю раствора цинкуранилацетата. Форму образовавшихся кристаллов наблюдают в микроскоп. Проведению реакции мешают ионы лития.
Реакция окрашивания пламени.
При внесении солей натрия в пламя горелки появляется желтая окраска пламени.
Реакция с гидротартратом натрия NaHC4H4O6:
K+ + HC4H4O6- = KHC4H4O6↓.
Образуется белый мелкокристаллический осадок гидротартрата калия, растворимый в кислотах и щелочах. Кристаллы осадка имеют характерную форму.
Методика проведения реакции. На предметное стекло наносят капилляром 1-2 капли анализируемого раствора, рядом наносят 1-2 капли гидротартрата натрия. Капли соединяют стеклянной палочкой и перемешивают. Стекло охлаждают и через несколько минут наблюдают в микроскоп форму образовавшихся кристаллов. Определению мешают ионы аммония.
Реакция с гексанитро(III)кобальтатом натрия Na3[Co(NO2)6]:
2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6]↓ + 2Na+.
Образуется осадок желтого цвета, растворимый в кислотах и щелочах.
Методика проведения реакции. В пробирку помещают 3 капли анализируемого раствора, содержащего ионы K+ и 3 капли раствора гексанитро(III)кобальтата натрия. После появления осадка проверяют его растворимость в кислотах или щелочах. Определению мешают ионы аммония.
Реакция окрашивания пламени.
При внесении солей калия в пламя горелки окраска пламени становится фиолетовой.
Реакция с гексанитро(II)купратом свинца и натрия:
2K+ + Pb[Cu(NO2)6]2- = K2Pb[Cu(NO2)6]↓.
Образуется осадок черного цвета, содержащий кристаллы характерной формы. Осадок растворим в кислотах и щелочах.
Методика проведения реакции. Каплю раствора, содержащего ионы калия, помещают на предметное стекло и высушивают на плитке. Добавляют каплю раствора гексанитро(II)купрата свинца и наблюдают под микроскопом форму образовавшихся кристаллов. Проведению реакции мешают катионы аммония.
| Закончив опыт, не забудьте занести записи в электронный лабораторный журнал и переслать на проверку преподавателю. | |
