При изучении органической химии особый интерес представляет электронное строение атома углерода, так как с этим связаны его свойства, определяющие во многом различия между органическими и неорганическими веществами.
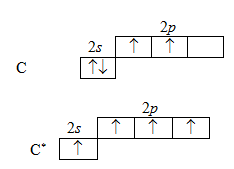
Углерод – первый элемент IV группы периодической системы элементов. Из курса общей химии известно, что электронная структура невозбужденного атома углерода может быть выражена формулой 1s22s22p2, т. е во втором (внешнем) электронном слое у него два спаренных (с противоположными спинами) s- электрона и только два неспаренных p-электрона, которые могут участвовать в образовании ковалентных связей. Следовательно, углерод должен был бы проявлять валентность, равную двум, однако надо учитывать, что атом углерода в момент химической реакции «возбуждается», т. е. переходит из основного состояния в возбужденное (С*). При этом происходит распаривание 2s-электронов и перехода одного их них на
2p-орбиталь. В результате такого перехода образуются четыре неспаренных электронов (один 2s- и три 2p-). Это возможно потому, что состояние 2s и 2p очень близки в энергетическом отношении. Затраченная при этом энергия (676,2 кДж/моль) затем
с избытком компенсируется при образовании четырех связей.
При образовании химических связей у атома углерода происходит гибридизация.
В зависимости от вида гибридизации атомы углерода могут находиться в трех валентных состояниях:
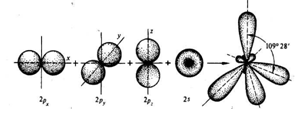
sp3 – гибридизация. При этом виде гибридизации происходит смешение одной 2s- и трех 2p – орбиталей. В результате образуются четыре одинаковые гибридные орбитали, расположенные в пространстве относительно друг друга под углом 109°28¢, образуя геометрическую фигуру – тетраэдр.
Рис.1 Схема образования четырех sp3 – гибридных атомных орбиталей.
Состояние углеродного атома с sp3-гибридными орбиталями называют первым валентным состоянием, и характерно для предельных углеводородов.
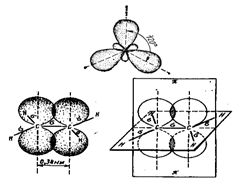
sp2- гибридизация. Эта гибридизация – результат смешения одной 2s- и двух 2p- орбиталей. При этом образуются три гибридные орбитали, расположенные в одной плоскости под углом 120 °С друг другу (плоскость равностороннего треугольника). Третья 2p-орбиталь, не принимающая участия в гибридизации, сохраняет свою прежнюю форму и располагается в плоскости, перпендикулярной плоскости гибридных связей.
Такое состояние атома углерода называется вторым валентным состоянием. Этот тип гибридизации характерен для углерода, когда при комбинации одной гибридной и одной негибридизованной орбитали образуется двойная связь (непредельные углеводороды ряда этилена).
Рис.2 Схема образования π – связи за счет перекрывания двух 2p – негибридизованных орбиталей.
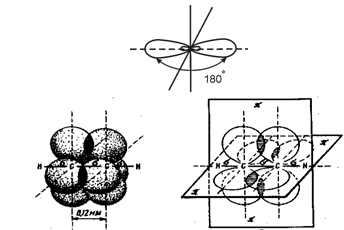
sp – гибридизация. При смешении одной 2s- и одной 2p- орбитали образуются две гибридные орбитали, расположенные на одной прямой линии. Остальные 2p – орбитали, не участвующие в гибридизации, расположены во взаимно перпендикулярных плоскостях. В результате чего, при формировании тройной кратной связи – С ≡ С – участвует одна гибридная и две негибридизованные орбитали каждого атома углерода Этот тип гибридизации характерен для ацетиленовых углеводородов с тройными связями.
Рис.3 Схема образования тройной связи в молекуле ацетилена.
Гибридизация – это смешение валентных электронных орбиталей, приводящее к образованию качественно новых, равноценных гибридных орбиталей с одинаковой формой и энергией, отличающиеся, только ориентацией в пространстве.