 При прохождении через слой вещества светового потока его первоначальная интенсивность Iо вследствие поглощения в слое, отражения и рассеяния уменьшается до значения I. Уменьшение интенсивности света при прохождении его через раствор подчиняется основному закону поглощения (закону Бугера – Ламберта – Бера):
При прохождении через слой вещества светового потока его первоначальная интенсивность Iо вследствие поглощения в слое, отражения и рассеяния уменьшается до значения I. Уменьшение интенсивности света при прохождении его через раствор подчиняется основному закону поглощения (закону Бугера – Ламберта – Бера):
где k – коэффициент светопоглощения, зависящий от природы растворителя и растворённого вещества, температуры и длины волны света. Если концентрация с выражена в моль/л, а l – в сантиметрах, то k представляет собой молярный коэффициент светопоглощения и обозначается ε, см2/моль. Тогда закон Бугера – Ламберта – Бера можно записать в виде
Величину называют оптической плотностью поглощающего вещества и обозначают буквой А:
Отношение интенсивности светового потока, прошедшего через слой вещества, к интенсивности первоначального потока называют пропусканием `T=I/I_0` :
Его значения могут меняться от 0 до 1. Оптическая плотность А и пропускание Т связаны уравнением
Согласно основному закону светопоглощения оптическая плотность раствора прямо пропорциональна концентрации поглощающего вещества, толщине слоя и молярному коэффициенту поглощения. При подчинении растворов основному закону поглощения наблюдается прямолинейная зависимость между оптической плотностью и концентрацией вещества в растворе при постоянном значении l.
Закон справедлив лишь для разбавленных растворов при следующих условиях: 1) монохроматичность, параллельность и ограниченная интенсивность проходящего через пробу светового потока; 2) постоянство температуры; 3) постоянство состава и неизменность поглощающих частиц в растворе, определяемые химизмом аналитической реакции и условиями её проведения. Если при изменении концентрации будет изменяться природа поглощающих частиц вещества вследствие, например, кислотно – основного взаимодействия, полимеризации, диссоциации и т.д., то зависимость А(с) не будет оставаться линейной, так как молярный коэффициент поглощения вновь образующихся и исходных частиц не будет в общем случае одинаковым (пример).
При определении иона металла Мn+ c использованием реагента HnR возможно протекание нескольких конкурирующих реакций, приводящих к отклонению от основного закона светопоглощения. Поэтому при фотометрическом определении исключительно важное значение имеет обеспечение преимущественного протекания основной аналитической реакции и подавление побочных процессов. Это достигается созданием оптимальных условий проведения реакции.
При разбавлении раствора K2Cr2O7 происходит не просто уменьшение концентрации иона Cr2O72−, а протекают процессы химического взаимодействия:
Cr2O72− + Н2О = 2НCrO4− = 2CrO42− + 2H+.
Так как спектры поглощения ионов Cr2O72− и CrO42− различны, зависимость оптической плотности от общей концентрации хрома в растворе не будет линейной.
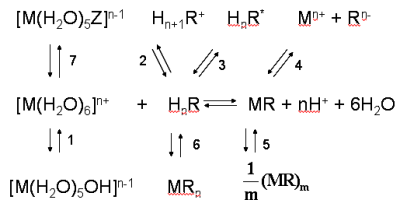
Рис.3.32. Возможные химические реакции, вызывающие отклонения от основного закона светопоглощения при фотометрическом определении иона металла Мn+ с органическим реагентом HnR:
1 – протолиз аквакомплекса металла; 2 – протонирование реагента; 3 – таутомерия реагента; 4 – ионизация комплекса; 5 – полимеризация комплекса; 6 – образование комплекса другого состава; 7 – конкурирующее комплексообразование Мn+ с посторонним лигандом