В аналитической химии существует два типа задач на расчет химических равновесий с помощью ЗДМ:
1) расчет равновесных концентраций реагирующих частиц (атомов, ионов, молекул) по заданным значениям их исходных концентраций и константам равновесия химических превращений в системе (прямая задача моделирования равновесий);
2) расчет констант равновесия химических превращений и исходных концентраций реагирующих частиц по массиву экспериментальных данных, функционально связанных с равновесными концентрациями химических форм в растворе (обратная задача моделирования равновесий).
В учебный курс аналитической химии включены только прямые задачи по расчету химических равновесий.
Предположим, что в водном растворе находится двухпротонная кислота Н2А. В таком растворе образуются следующие равновесные системы:
Запишем уравнение материального баланса для кислоты Н2А
cH2A= [H2A] + [HA−] + [A2−].
Наряду с этим можно записать еще уравнение электронейтральности раствора
.PNG)
Эти выражения составляют систему 4 уравнений для 4 неизвестных: [H+], [HA−] [A2−] и [H2A], точное решение которой является нелегкой задачей. Однако во многих случаях прямую задачу по расчету химических равновесий можно решить с приемлемой точностью упрощенным способом, если расчеты проводить с использованием суммарной константы равновесия.
Предположим, что в растворе образуются соединения АВ и QR, которые частично диссоциируют по реакциям
АВ ↔ А+ + В−;
QR ↔ Q+ + R−,
а ионы А+ и R− взаимодействуют с образованием ARn(n-1)− по реакции
A++nR- ↔ ARn(n-1)-.
Запишем суммарную реакцию:
Общая (суммарная) константа равновесия в этой системе 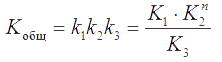
В подобных задачах почти всегда приходится решать уравнения высоких степеней. Однако их часто можно предельно упростить, если в качестве одной из неизвестных концентраций взять минимальную, чтобы иметь возможность пренебречь ею при расчете алгебраических сумм (пример 4). При этом если константа равновесия реакции велика, то в качестве неизвестной берут равновесную концентрацию одного из исходных компонентов реакции, а если она мала – то равновесную концентрацию продукта реакции.
Пример 4. Вычислить равновесные концентрации всех ионов после завершения реакции
6Fe2+ + Cr2O72− + 14H+ ↔ 6Fe3+ + 2Cr3+ + 7H2O,
константа равновесия которой K = 1056, если исходные молярные концентрации компонентов реакции с(Fe2+) = 0,3 M; c(Cr2O72−) = 0,01 M; c(H+) = 0,07 M.
Решение. Константа велика, равновесие реакции сдвинуто вправо, поэтому минимальную концентрацию следует искать среди равновесных концентраций исходных веществ.
Воспользуемся следующим алгоритмом решения задачи; под компонентами равновесия реакции (R) выписываем в первой строке исходные концентрации участников реакции (с), в следующей строке – равновесные концентрации [R] и в последней строке – убыль исходных концентраций (у). (Размерность опускают, поскольку значения начальных и равновесных концентраций всегда выражены в моль/л раствора).
Из условий задачи видно, что минимальной будет концентрация ионов водорода, поскольку концентрации других ионов взяты в избытке. Удобно за первую неизвестную концентрацию (х) взять не саму величину [H+], а кратную ей 14х, т.е. положить [H+] = 14х.
Найдем выражения для остальных равновесных концентраций. Для этого сначала получим выражения для убыли (у) исходных концентраций всех компонентов реакции. Начнем с убыли концентрации ионов водорода. Если начальная концентрация этих ионов 0,07 М, а их равновесная концентрация 14х, то убыль yH+ составляет 0,07 – 14х.
Для расчета убыли концентрации ионов Fe2+ воспользуемся правилом эквивалентности:
| 6Fe2+ | — | 14H+ |
| y(Fe2+) | — | (0,07 – 14x). |
Решая эту пропорцию, находим: y(Fe2+)= 3(0,01 – 2х) = 0,03 – 6х. Тогда равновесная концентрация [Fe2+] = 0,3 – 0,03 + 6x = 0,27 + 6x.
Аналогично этому
| Cr2O72− | — | 14H+ |
| y(Cr2O72−) | — | (0,07 – 14x). |
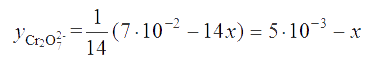
Следовательно, равновесная концентрация [Cr2O72−] = 0,01 – 5×10-3 + х = 5×10-3 + х.
Выразим теперь равновесную концентрацию ионов Fe3+:
| 6Fe3+ | — | 14H+ |
| [Fe3+] | — | (0,07 – 14x). |
Отсюда имеем .
Осталось выразить равновесную концентрацию ионов Cr3+:
| 2Cr3+ | — | 14H+ |
| [Cr3+] | — | (0,07 – 14x). |
Следовательно, .
В итоге получаем следующую равновесную систему:
|
R |
Fe2+ |
Cr2O72- |
H+ |
Fe3+ |
Cr3+ |
|
с |
0,3 |
0,01 |
0,07 |
|
|
|
[R] |
0,27 + 6x |
5×10-3 + x |
14x |
0,03 - 6x |
10-2 - 2x |
|
y |
0,03 - 6x |
5×10-3 - x |
0,07 - 14x |
|
|
Запишем для нее константу равновесия:
.PNG)
Подставим сюда найденные выражения для равновесных концентраций ионов:
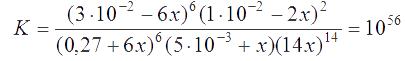
Это уравнение легко решить приближенно, поскольку вторыми слагаемыми в алгебраических суммах ввиду малости значений х можно пренебречь. В результате получаем решение: х = 2×10-6. Таким образом, концентрации ионов при установившемся равновесии равны: [H+] = 14x = 2,8×10-5 M; [Fe2+] = 0,27 + 6x ≅ 0,27 М; [Cr2O72-] = 5×10-3 + x = 5,002×10-3 M; [Fe3+] = 0,03 - 6x = 2,999×10-2 M; [Cr3+] = 0,01 - 2x = 9,996×10-3 M.
Если минимальная концентрация сопоставима по величине с другими равновесными концентрациями веществ в системе, то приходится решать уравнения высоких степеней по общим правилам, используя, например, итерационную процедуру Ньютона.
.PNG)
.PNG)