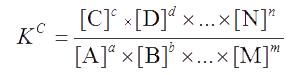Закон действия масс (ЗДМ) устанавливает количественные соотношения между концентрациями продуктов реакции и исходных реагентов при установившемся равновесии в реакционной системе. Для обратимой реакции
aA + bB + ... + mM ⇔ cC + dD + ... + nN
скорость прямой реакции V1 реальной системы при постоянной температуре прямо пропорциональна активности реагирующих веществ, в степенях, равных соответствующим стехиометрическим коэффициентам реакции:
где k1 - коэффициент пропорциональности (константа скорости прямой реакции), зависящий от природы реагирующих веществ и температуры.
Аналогично можно записать скорость обратной реакции:
.
По мере взаимодействия исходных веществ их активности уменьшаются; следовательно, постепенно уменьшается начальная скорость прямой реакции V1. С другой стороны, по мере накопления продуктов реакции их активности возрастают; следовательно, скорость обратной реакции V2 постепенно увеличивается. Наконец скорости выравниваются V1 = V2. Наступает химическое равновесие. Оно является динамическим (подвижным): химическое взаимодействие не прекращается, а продолжает идти с одинаковой скоростью в обоих направлениях – слева направо и справа налево.
Поскольку в момент химического равновесия V1 = V2, поэтому
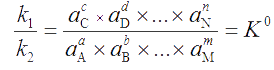
Это запись закона действия масс. Его формулировка: «При установившемся химическом равновесии в обратимой реакции отношение произведения равновесных активностей конечных продуктов реакции к произведению равновесных активностей исходных компонентов, взятых в степенях, равных соответствующим стехиометрическим коэффициентам реакции, есть величина постоянная».
Величина К0, постоянная при данной температуре, – термодинамическая константа равновесия реакции. Она зависит только от природы реагентов, температуры и не зависит от концентрации реагирующих веществ.
В выражение константы равновесия не входят активности веществ в их стандартном состоянии (твердые кристаллические вещества, растворитель), которые принимаются равными 1.
Числовые значения К0 для разных реакций в стандартных условиях (298 К, атмосферное давление) приведены в справочной литературе.
Закон действия масс можно записать и через равновесные концентрации:
Величина КС – концентрационная константа равновесия. Учитывая связь между активностью и концентрацией каждого реагента (a = γ·c), величину КС можно связать с величиной К0 через коэффициенты активности.
Для обратимой реакции: аА + bB ⇔ dD + eE
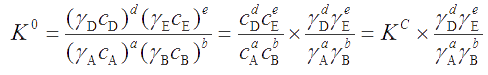
Отсюда можно выразить концентрационную константу равновесия
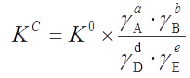
которая зависит не только от природы реагентов и температуры, но и от ионной силы раствора – I. Она постоянна при постоянных Р, Т и I.
В анализируемом растворе ионы, участвующие в основной реакции (А + В ⇔ D + E), могут вступать в побочное взаимодействие с посторонними ионами (например, вещество D участвует еще и в побочной реакции с компонентом Р: D + P ⇔ DP – побочная реакция).
Такое участие вещества D может быть учтено с помощью условной (кажущейся) константы реакции.
Вещество D существует в форме собственно вещества D и в форме вещества DP, поэтому его общая аналитическая концентрация будет равна: c(D) = [D] + [DP].
Мольная доля компонента D в этой системе определяется соотношением , откуда
Подставив значение [D] в выражение для концентрационной константы равновесия основной реакции: 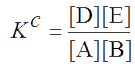
. Величину
называют условной или кажущейся константой равновесия. С учетом этого
, откуда
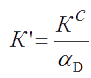
Если и другие компоненты основного равновесия участвуют в каких-либо побочных реакциях, то условная константа будет включать общие концентрации всех веществ основной реакции: 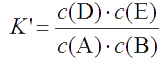
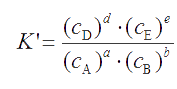
Условная константа равновесия основной реакции 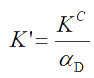
Термодинамическая, концентрационная и условная константы равновесия связаны между собой соотношением
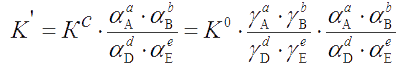
Смешанные константы являются симбиозом термодинамических и концентрационных констант. Содержание одного из ионов в них выражено через активность, а остальных – через равновесные концентрации. В такой форме иногда выражают константы ионизации кислот, оснований и кислотно-основных индикаторов. Причем через активность выражают содержание ионов Н+ или ОН-. Использование смешанной константы выгодно в ряде практических случаев, например при определении рН перехода окраски индикаторов в титриметрическом анализе. Очевидно, что смешанная константа зависит от ионной силы раствора.
Суммарная константа равновесия используется в тех случаях, когда в системе протекают одновременно две или более конкурирующие химические реакции.