Анализируемая смесь катионов IV–VI групп может представлять собой раствор или раствор с осадком. В осадке могут быть гидроксиды, карбонаты и фосфаты некоторых ионов металлов или продукты взаимодействия солей Sb3+ и Bi3+ с растворителем (SbOCl, BiOCl).
Прежде чем приступить к систематическому ходу анализа, следует провести предварительные испытания, которые помогут при интерпретации результатов. Целесообразно обнаружить ряд катионов дробным методом, используя специфические и избирательные реакции, маскируя мешающие ионы.
Предварительные испытания
1. Обращают внимание на цвет раствора и осадка, делают вывод о возможном наличии или отсутствии окрашенных ионов.
2. Определяют рН раствора с помощью универсальной индикаторной бумаги.
3. Если в растворе присутствует осадок, проверяют его растворимость в кислотах и щелочах. Полное растворение осадка в 2 М растворе HCl указывает на возможное присутствие в его составе карбонатов, фосфатов и гидроксидов катионов, а также SbOCl и BiOCl.
4. Аналогично проверяют растворимость осадка в избытке 2 М NaOH (KOH). Если осадок растворяется полностью или частично, в его состав могут входить гидроксиды амфотерных катионов IV группы.
После проведения предварительных испытаний анализируемый раствор с осадком помещают в пробирку и добавляют минимальное количество 2 М HCl для растворения осадка. В отдельных порциях этого раствора обнаруживают катионы дробным методом.
Обнаружение катионов IV–VI групп дробным методом
Половину раствора со взмученным осадком отделяют и сохраняют в случае необходимости повторного анализа.
Обнаружение Fe(III) и Fe(II). Ионы Fe3+ и Fe2+ обнаруживают в исходном растворе, так как в ходе анализа их степень окисления может изменяться. Для обнаружения катиона Fe2+ используют реакции с K3[Fe(CN)6] в кислой среде или с α-,α'-дипиридилом, а катион Fe3+ открывают реакцией с NH4SCN.
Обнаружение Сr3+. Катион Сr3+ обнаруживают окислением его пероксидом водорода в щелочной среде до хромат-ионов желтого цвета, которые затем в кислой среде при действии избытка Н2О2 образуют надхромовую кислоту H2CrO6.
Обнаружение Al3+. Катион Al3+ открывают капельным методом с ализарином или алюминоном.
Обнаружение Мn2+ проводят, используя реакцию окисления Mn2+ до MnO4– в кислой среде. В присутствии ионов Fe3+ желтую окраску раствора устраняют добавлением 1–2 капель 2 М H3PO4 для связывания Fe3+ в бесцветный комплекс.
Обнаружение Mg2+. Катион Mg2+ открывают гидрофосфатом натрия Na2HPO4 в присутствии NH4OH (pH 9). Образуется белый кристаллический осадок MgNH4PO4·6H2O. Но сначала устраняют мешающее влияние катионов, образующих малорастворимые фосфаты. Для этого к части анализируемого раствора добавляют концентрированный раствор NH4OH до щелочной среды, 3–5 капель 3%-ного раствора H2O2 для перевода Cr3+ в CrO42–, перемешивают и нагревают 1 мин на кипящей водяной бане. Осадок отделяют центрифугированием. В центрифугате остаются Mg2+, CrO42–, аммиачные комплексы кобальта, меди, никеля, цинка и кадмия, которые не мешают обнаружению Mg2+.
Катион Mg2+ можно обнаружить капельным методом с магнезоном (I) или магнезоном (II). На предметное стекло наносят 2–3 капли анализируемого раствора и одну каплю реактива. При наличии катиона Mg2+ появляется осадок или посинение раствора. Если смесь окрашивается в желтый цвет, добавляют 2–3 капли 2 М раствора NaOH.
Обнаружение Со2+ проводят тиоцианатом аммония (калия) NH4SCN при рН 4–5 в виде окрашенного в синий цвет комплексного соединения, экстрагируемого изоамиловым спиртом. Мешающее влияние CuSCN устраняют добавлением концентрированной HNO3, а ионов железа (III) – твердого NH4F (шпатель).
Обнаружение Ni2+. Катион Ni2+ открывают наиболее характерной и чувствительной реакцией с диметилглиоксимом (реактив Л.А. Чугаева). Но прежде к анализируемому раствору добавляют 2–3 капли раствора винной кислоты, чтобы предотвратить выпадение окрашенных гидроксидов металлов, связав их в комплекс. Обнаружению Ni2+ мешает Fe2+. Его окисляют до Fe3+ добавлением 1–2 капель концентрированной HNO3 при нагревании.
Обнаружение Cu2+. Действуя концентрированным раствором аммиака, открывают Cu2+ в виде аммиачного комплекса интенсивно-синего цвета.
Систематический анализ смеси катионов IV–VI групп
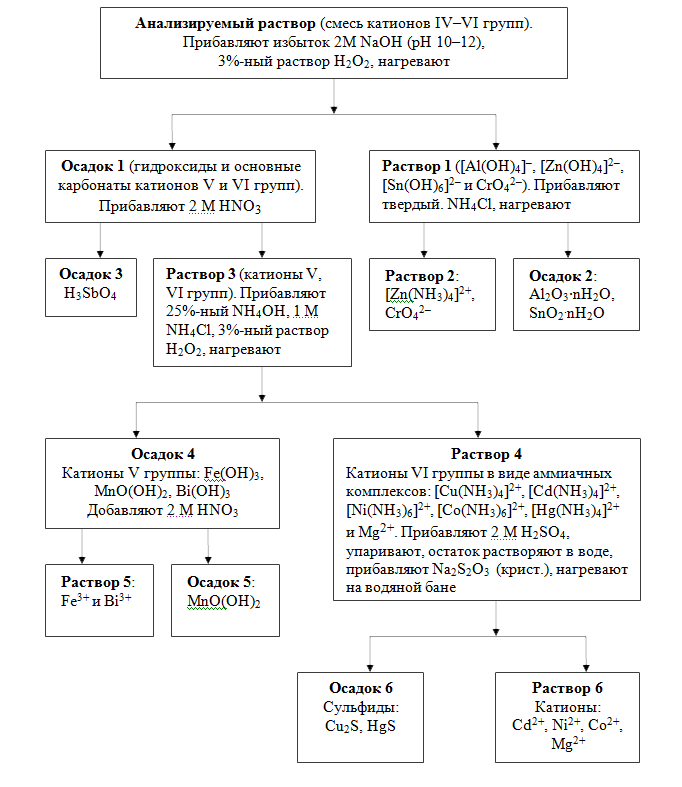
Систематический ход анализа предполагает проведение операций разделения смеси катионов на аналитические группы и внутри групп. Если в растворе присутствует осадок, его отделяют центрифугированием. К осадку добавляют несколько капель 6 М HCl и нагревают при перемешивании. При этом полностью растворяются карбонаты, фосфаты и гидроксиды катионов, а также SbOCl и BiOCl, образуя ионы [SbCl6]3– и Bi3+. Раствор, полученный растворением осадка, присоединяют к основному раствору смеси катионов IV–VI групп и приступают к систематическому анализу, используя Схема разделения смеси катионов IV–VI групп действием групповых реагентов (табл. 7.10).
Отделение катионов IV группы от катионов V, VI групп. К 10–15 каплям анализируемого раствора, содержащего смесь катионов IV–VI групп, прибавляют 2 М раствор NaOH до щелочной реакции (по индикатору) и еще 10 капель избытка (рН 10–12). Постепенно при перемешивании добавляют 4–5 капель 3%-ного раствора Н2О2. После прекращения бурной реакции нагревают на водяной бане несколько минут. Центрифугируют и отделяют осадок от раствора.
Раствор 1: гидроксокомплексы катионов IV группы и CrO42–.
Осадок 1: гидроксиды и основные карбонаты катионов V, VI групп.
Разделение катионов IV группы. К раствору 1 добавляют NH4Cl (тв.) до насыщения и нагревают. Центрифугированием отделяют раствор 2 от осадка 2.
Раствор 2: [Zn(NH3)4]2+, CrO42–.
Осадок 2: Al2O3∙nH2O, SnO2∙nH2O.
Обнаружение Zn2+. Используют реакцию с дитизоном. Для этого часть аммиачного раствора 2 нагревают с насыщенным раствором Na2CO3 до полного удаления аммиака. Выпавший основной карбонат цинка отделяют центрифугированием и промывают разбавленным раствором Na2CO3. Осадок Zn2(OH)2CO3 растворяют в 2 М HCl и обнаруживают Zn2+.
Обнаружение Cr3+. Если в исходном растворе присутствовали катионы Cr3+, то раствор 1 будет окрашен в желтый цвет (CrO42–). Для доказательства присутствия CrO42– в растворе 2 используют реакцию образования пероксокомплексов.
Обнаружение и отделение Sn(IV). Осадок 2 растворяют в 2 М HCl при нагревании. Для обнаружения Sn(IV) используют реакцию с Hg(NO3)2 или микрокристаллоскопическую реакцию получения кристаллов (NH4)2[SnCl6]. На предметное стекло помещают каплю раствора, полученного от растворения осадка 2, добавляют каплю 1 М раствора NH4ОН, в случае образования мути добавляют каплю 2 М НСl, выпаривают до появления каемки и рассматривают под микроскопом. В присутствии [SnCl6]2– образуются бесцветные октаэдрические кристаллы. Если Sn(IV) обнаружено, ко всему раствору добавляют немного металлического цинка и взбалтывают. В случае его помутнения добавляют по каплям 2 М HCl до просветления. Образовавшееся металлическое олово и избыток цинка отделяют центрифугированием. В центрифугате обнаруживают Al3+.
Обнаружение Al3+. Для обнаружения используют реакцию с ализарином.
Отделение H3SbO4 от гидроксидов катионов V и VI групп. Осадок 1 промывают 2 М NaOH, добавляют 2 мл 2 М HNO3 и несколько капель 3%-ного раствора Н2О2. Нагревают на водяной бане и отделяют раствор катионов V, VI групп от осадка H3SbO4 центрифугированием.
Раствор 3: Fe3+, Mn2+, Bi(III), Mg2+, Cu2+, Ni2+, Co2+, Cd2+, Hg2+.
Осадок 3: H3SbO4.
Обнаружение Sb(V). Осадок 3 (H3SbO4) промывают 2 М HNO3 и растворяют в 5–6 каплях HCl (конц.). Полученный раствор разбавляют в 2 раза водой и обнаруживают в нем [SbCl6]– реакцией восстановления металлами или действием H2O.
Отделение катионов Fe3+, Mn(IV) и Bi(III) от катионов VI группы и Mg2+. К раствору 3 добавляют концентрированный раствор NH4ОН до щелочной реакции, несколько капель раствора NH4Cl и 1–2 капли 3%-ного раствора Н2О2. Нагревают при перемешивании, отделяют осадок 4: Fe(OH)3, MnO(OH)2, Bi(OН)3 от раствора 4 (аммиачные комплексы катионов VI группы и катион Mg2+).
Раствор 4: аммиачные комплексы катионов VI группы и катион Mg2+.
Осадок 4: Fe(OH)3, MnO(OH)2, Bi(OН)3.
Отделение MnO(OH)2. К осадку 4 добавляют 5–6 капель 2 М раствора HNO3. Раствор, содержащий катионы Fe3+ и Bi3+, отделяют от осадка MnO(OH)2 центрифугированием.
Раствор 5: Fe3+ и Bi3+.
Осадок 5: MnO(OH)2.
Обнаружение Mn2+. Осадок 5 растворяют в 2 М HNO3 и 2–3 каплях 3%-ного раствора Н2О2. Избыток Н2О2 удаляют нагреванием на водяной бане. В полученном растворе обнаруживают Мn2+ по реакции с NaBiO3.
Обнаружение Bi3+. В растворе 5, содержащем Fe3+ и Bi3+, обнаруживают только висмут. Для этого используют реакцию с Na2[Sn(OH)4]. Если Fe3+ отсутствует, для обнаружения Bi3+ можно использовать капельную реакцию образования ионного ассоциата BiI4– c 8-оксихинолином.
По цвету раствора 4 можно предположить наличие отдельных катионов VI группы. Так, аммиачные комплексные соединения меди окрашены в темно-синий, никеля – в голубой, а кобальта – в бурый цвет. Если результаты дробного обнаружения катионов VI группы и катиона Mg2+ в анализируемом растворе вызывают сомнения, то их обнаружение повторяют в растворе 4, используя указанный ранее дробный метод. При этом катион Hg2+ открывают реакцией с KI, а катион Cd2+ – реакцией с дифенилкарбазидом, устраняя мешающее влияние ионов Cu(II) и Hg(II) добавлением KSCN или KI. Для анализа раствора 4 можно применить и систематический анализ.
Отделение Cu2+ и Hg2+ от других катионов VI группы и Mg2+.
Раствор 4 помещают в фарфоровую чашку, добавляют к нему 2 М H2SO4 до кислой реакции и упаривают досуха для удаления нитрат-ионов. Сухой остаток растворяют в нескольких каплях воды, переносят раствор в пробирку и постепенно вносят несколько кристаллов Na2S2O3·5Н2О. Нагревают на водяной бане. Осадок сульфидов меди и ртути (Cu2S, HgS) отделяют от раствора, содержащего Co2+, Ni2+, Cd2+ и Mg2+.
Раствор 6: Co2+, Ni2+, Cd2+ и Mg2+.
Осадок 6: Cu2S, HgS.
Растворение Cu2S и обнаружение Cu2+. Осадок 6 сульфидов меди (I) и ртути (II) обрабатывают 5–6 каплями 3 М HNO3 при нагревании. В растворе обнаруживают Cu2+ по реакции с NH4ОН или K4[Fe(CN)6], в осадке остается HgS (черного цвета).
Растворение HgS и обнаружение Hg2+. Часть осадка HgS обрабатывают 5–6 каплями царской водки и выпаривают раствор на водяной бане для удаления HCl и HNO3. Остаток разбавляют несколькими каплями Н2О и открывают Hg2+ с KI или SnCl2.
Отделение и обнаружение Mg2+. К раствору 6 добавляют немного NH4Cl, препятствующего образованию гидроксида магния, Na2HPO4 и водный раствор NH4ОН (до рН~9). Выпадает белый кристаллический осадок MgNH4PO4. Осадок отделяют от раствора центрифугированием. В растворе обнаруживают Co2+, Ni2+ и Cd2+.
Обнаружение Cd2+. К нескольким каплям центрифугата прибавляют 2 М H2SO4 до сильнокислой реакции и 1–2 капли раствора Na2S. По каплям добавляют 10%-ный раствор NH4ОН до рН 0,5–1,0 (по индикатору). В присутствии Cd2+ выпадает желтый осадок CdS.
Кадмий можно обнаружить действием дифенилкарбазида в нейтральной и слабокислой среде.
Обнаружение Co2+ и Ni2+. Для обнаружения Co2+ и Ni2+ используют реакции, указанные в дробном методе.
Т а б л и ц а 7.10
Схема разделения смеси катионов IV–VI групп действием групповых реагентов