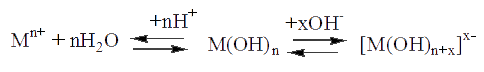К четвертой аналитической группе относят катионы Al3+, Cr3+, Zn2+, Sn2+, Sn4+. Групповым реагентом является щелочь (NaOH или КОН), при взаимодействии с которой образуются осадки гидроксидов, растворимые в избытке реактива (табл. 7.6).
Состояние ионов в растворе
В водных растворах катионы четвертой аналитической группы находятся в виде гидратированных ионов [Al(H2O)6]3+, [Cr(H2O)6]3+, [Zn(H2O)4]2+, проявляющих свойства кислот за счет сильного отталкивания протонов координационно-связанной воды ионами металлов, вследствие чего образуются ионы гидроксония Н3О+ и гидроксоаквакомплексы металлов. На примере Al3+ реакция диссоциации гидратированного иона протекает следующим образом:
[Al(H2O)6]3+ + H2O = [Al(OH)(H2O)5]2+ + H3O+.
Аквакомплекс [Al(H2O)6]3+, таким образом, обладает кислотными свойствами (рКа1 = 4,96), приблизительно равными по силе уксусной кислоте. Реакция диссоциации аквакомплекса алюминия в водных растворах при определенных условиях может идти далее:
[Al(OH)(H2O)5]2+ + H2O = [Al(OH)2(H2O)4]+→[Al(OH)3(H2O)3] + 2H3O+.
Аналогично ионы Cr3+ в водных растворах существуют в виде [Cr(H2O)6]3+, [Cr(OH)(H2O)5]2+ и т.д.; ионы Zn2+ – в виде [Zn(H2O)4]2+, [Zn(OH)(H2O)3]+. Соли олова в водной среде наиболее сильно проявляют кислотные свойства. В них присутствует ряд различных гидроксокатионов: [Sn(H2O)2(OH)]+, [Sn2(H2O)4(OH)2]2+ и т.д. В кислой среде, содержащей Cl–-ионы, катионы Sn2+, Sn4+, вероятней всего, будут находиться не в виде гидроксоаквакомплексов, а в виде хлоридных комплексов [SnCl4]2– и [SnCl6]2–, как наиболее устойчивых по сравнению с катионами Al3+, Cr3+, Zn2+.
Осаждение катионов групповым реагентом
При добавлении в эквимолекулярном соотношении группового реагента к растворам, содержащим катионы IV аналитической группы, образуются малорастворимые гидроксиды:
[Al(H2O)6]3+ + 3OH– = [Al(OH)3(H2O)3]↓ + 3H2O
или упрощенноAl3+ + 3OH– = Al(OH)3↓
[Cr(H2O)6]3+ + 3OH– = [Cr(OH)3(H2O)3]↓ + 3H2O,
илиСr3+ + 3OH– = Cr(OH)3↓
[Zn(H2O)4]2+ + 2OH– = [Zn(OH)2(H2O)2]↓ + 2H2O,
илиZn2+ + 2OH– = Zn(OH)2↓
Sn2+ + 2OH– = Sn(OH)2↓,
[SnCl4]2– + 2OH– = Sn(OH)2↓ + 4Cl– (в присутствии HCl),
Sn4+ + 4OH– + 2H2O = H2[Sn(OH)6]↓
Все осадки гидроксидов белого цвета, за исключением Cr(OH)3, имеющего серо-фиолетовую окраску.
Гидроксиды элементов IV аналитической группы обладают амфотерными свойствами. Они способны растворяться как в щелочах, так и в кислотах. Поэтому изменение рН раствора от кислой среды к щелочной (и наоборот) приводит к смещению равновесия:
Растворение в щелочах
[Al(OH)3(H2O)3]↓ + OH– = [Al(OH)4(H2O)2 ]– +H2O
или упрощенноAl(OH)3↓ + OH– = [Al(OH)4]–.
Аналогично:
Zn(OH)2↓ + 2OH– = [Zn(OH)4]2–,
Cr(OH)3↓ + OH– = [Cr(OH)4]–,
Sn(OH)2↓ + OH– = [Sn(OH)3]–,
H2[Sn(OH)6]↓ + 2OH– = [Sn(OH)6]2– + 2H2O.
Растворение в кислотах
При растворении гидроксидов в кислотах образуются соли катионов IV группы:
[Al(OH)3(H2O)3]↓ + 3H3O+ = [Al(H2O)6]3+ +3H2O
или сокращенноAl(OH)3↓ + 3H+ = Al3+ + 3H2O
[Zn(OH)2(H2O)2]↓ + 2H3O+ = [Zn(H2O)4]2+ + 2H2O
или сокращенноZn(OH)2↓ + 2H+ = Zn2+ + 2H2O,
Cr(OH)3↓ + 3H+ = Cr3+ + 3H2O,
Sn(OH)2↓ + 2H+ = Sn2+ + 2H2O (в H2SO4);
в среде хлороводородной кислоты HCl:
Sn(OH)2 +2H+ + 4Cl– = [SnCl4]2– + 2H2O,
H2[Sn(OH)6]↓ + 6HCl = H2[SnCl6] + 6H2O.
В дальнейшем, в целях упрощения, мы будем пользоваться в написании более простыми формулами, не осложненными сольватационными (гидратационными) процессами.
При выполнении реакции взаимодействия катионов IV аналитической группы со щелочами NaOH или КОН следует групповой реагент прибавлять по каплям, наблюдая сначала выпадение, а потом растворение осадка. Катионы алюминия и цинка в растворах имеют постоянную степень окисления, остальные ионы – переменную и в зависимости от степени окисления проявляют свойства окислителей или восстановителей.
Обзор действия основных реагентов на катионы четвертой группы.
Т а б л и ц а 7.6
Действие основных реагентов на катионы четвертой группы
|
Реактив |
Al3+ |
Cr3+ |
Zn2+ |
Sn(II) |
Sn(IV) |
|
NaOH |
Al(OH)3 – белый осадок, растворим в NaOH, HCl |
Cr(OH)3 – серо-зеленый осадок, растворим в NaOH, HCl и NH4OH |
Zn(OH)2 – белый осадок, растворим в NaOH, HCl и NH4OH |
Sn(OH)2 – белый осадок, растворим в NaOH, HCl |
H2[Sn(OH)6] – белый осадок, растворим в NaOH, HCl |
|
NH4OH |
Al(OH)3 – белый осадок, растворим в HCl, NaOH |
Cr(OH)3 – серо-зеленый осадок, растворим в NaOH, HCl и NH4OH |
Zn(OH)2 – белый осадок, растворим в HCl, NaOH и NH4OH |
Sn(OH)2 – белый осадок, растворим в HCl, NaOH |
H2[Sn(OH)6] – белый осадок, растворим в HCl, NaOH |
|
Na2HPO4 |
AlPO4 – белый осадок, растворим в кислотах, щелочах |
CrPO4 – зеленый осадок, растворим в кислотах, щелочах |
Zn3(PO4)2 – белый осадок, растворим в кислотах и аммиаке |
(Sn3(РО4)2 + SnHPO4) – белый осадок, растворим в кислотах |
Адсорбционное соединение мета-оловянной кислоты с фосфорной |
|
(NH4)2S в среде (NH4OH + NH4Cl) |
Al(OH)3 – белый осадок |
Cr(OH)3 – серо-зеленый осадок |
ZnS – белый осадок, растворим в кислотах |
SnS – бурый осадок, растворим в кислотах |
Осаждается лишь H2S в среде HCl |
|
Соли слабых кислот (Na2CO3, Na2SO3, CH3COONa и др.) |
Al(OH)3 – белый осадок, вследствие протолиза соли |
Сr(OH)3 – серо-зеленый осадок |
Zn2(OH)2CO3 – белый осадок (под действием Na2CO3) |
Sn(OH)2 – белый осадок |
H2[Sn(OH)6] – белый осадок |
|
Окислители |
– |
CrO42– – желтый цвет (H2O2 + OH–), Cr2O72– – оранжевый ((NH4)2S2O8 + H+) |
– |
[SnCl6]2– окислители HgCl2, Bi(NO3)3 |
– |
|
Восстановители (Mg, Fe, Al, Zn и др.) |
– |
– |
– |
– |
[SnCl4]2– |