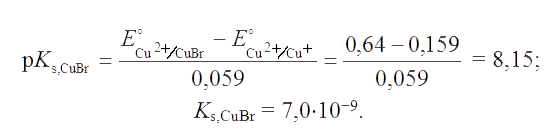Направление реакций окисления-восстановления определяется величинами окислительно-восстановительных потенциалов, зависящими от природы редокс-пар, участвующих в реакции, и условий проведения эксперимента (рН среды, явлений образования комплексов и осадков в системе). Окислительно-восстановительная реакция
всегда протекает в том направлении, для которого разность между стандартными потенциалами пары, включающей окислитель, и пары, включающей восстановитель, больше нуля. То есть при реакция будет протекать слева направо, а при
- справа налево. Равновесие в системе наступит при ΔE° = 0.
С учетом соотношения концентраций компонентов редокс-пар задача определения направления реакции решается сопоставлением их потенциалов:
Е1 > E2 - реакция протекает слева направо;
Е1 < E2 - реакция протекает справа налево;
Е1 = E2 - в системе устанавливается равновесие.
Все же неравенство Е1 ≠ E2, следовательно, и направление реакции определяется главным образом знаком разности стандартных потенциалов ΔE°.
На направление реакции указывает также величина константы равновесия. Рассмотрим на конкретных примерах влияние условий эксперимента на направление окислительно-восстановительных реакций.
Влияние комплексообразования. Потенциал редокс-пары, например M3+/M2+, в отсутствие комплексантов равен 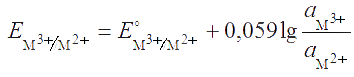
При взаимодействии иона M3+ с лигандом L- по реакции M3+ + L- ↔ ML2+ активность иона М3+ снижается и становится равной: 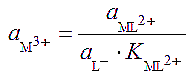
где 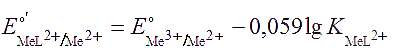
Из выражения для расчета видно, что стандартный потенциал изменяется тем больше, чем прочнее комплекс. В рассматриваемом случае происходит уменьшение потенциала, т.е. окислительной способности пары (пример 55). В реакцию взаимодействия с одним и тем же комплексантом может вступать как окисленная, так и восстановленная форма металлической пары. Однако в большинстве случаев окисленная форма образует более прочный комплекс. В таких случаях реальный потенциал меньше стандартного потенциала Е°, который фигурирует в справочных руководствах.
Влияние концентрации ионов водорода. Увеличение концентрации водородных ионов, если они принимают участие в процессе восстановления окисленной формы, способствует усилению этого процесса (пример 56).
Влияние фактора образования малорастворимого соединения. Потенциал системы может существенно измениться, если одна из форм редокс-пары образует малорастворимое соединение с каким-либо ионом раствора электролита. Например, потенциал пары Cu2+/Cu+ возрастает в присутствии йодид- или тиоцианат-ионов, т.к. образуются малорастворимые соединения CuI и CuSCN (пример 57).
Информацию о влиянии процессов образования комплексных и малорастворимых соединений, рН среды и ионной силы раствора на окислительно-восстановительные свойства различных пар можно получить из справочной литературы. Например, для пары Fe3+/Fe2+ (E°Fe3+/Fe2+ = 0,771 B) присутствие цианид-ионов существенно ослабляет ее окислительные свойства (E°Fe(CN)63−/Fe(CN)64− = 0,364 B) вследствие образования более прочного цианидного комплекса Fe3+ по сравнению с Fe2+. Однако присутствие 1,10 фенантролина значительно повышает окислительные свойства данной пары (E°Fe(C12H8N2)3+/Fe(C12H8N2)2+ = 1,01 В) за счет большего снижения активности иона Fe2+. Аналогично можно показать, что стандартный потенциал пары Cu2+/Cu+ (E°Cu2+/Cu+ = 0,159 B) в присутствии йодид-ионов может существенно увеличиться за счет образования малорастворимого соединения CuI (Ks,CuI = 1,2×10-12; E°Cu2+/CuI = E°Cu2+/Cu+ - 0.059lgKs,CuI = 0,159 + 0,059×11,92 = 0,862 B). Зная стандартные редокс-потенциалы в реальных условиях, можно оценить константу устойчивости комплекса, произведение растворимости малорастворимого соединения или рН среды (пример 58).
Стандартные потенциалы окислительно-восстановительных пар, рассчитанные с учетом влияния на них ионной силы и рН среды, а также побочных взаимодействий компонентов пар с посторонними (или вспомогательными) частицами в растворе, являются формальными (реальными) потенциалами. Они являются константами только при постоянных температуре, ионной силе, рН среды и концентрациях частиц, реагирующих с компонентами пар с образованием комплексных или малорастворимых соединений.
Решение. Согласно уравнению Нернста,
Константа равновесия реакции
Реакция пойдет по направлению
Согласно ЗДМ, константа равновесия реакции . Так как К >> 1, то х << 0,1. Пренебрегая величиной х в алгебраических суммах, приходим к простому уравнению 1,5×10-3 = 107,89×4х4, откуда х = 1,5×10-3 . Следовательно, [I-] = [Fe3+] = 3×10-3 M; [Fe2+] = 0,2 M; [I2] = 0,15 M.
Определим направление приведенной выше реакции в присутствии 1,5 М NaF:
Подставляя равновесные концентрации в уравнение для суммарной константы устойчивости фторидного комплекса железа, имеем 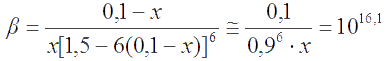
что меньше 0,54 В. Стало быть, в присутствии 1,5 М NaF реакция с участием редокс-пар Fe3+/Fe2+ и I2/2I- пойдет по направлению 2Fe2+ + I2 → 2Fe3+ + 2I-.
Решение. В системе протекают редокс-переходы:
H3AsO4 + 2ē + 2Н+ ↔ H3AsO3 + Н2О; I2 + 2ē ↔ 2I¯.
Согласно уравнению Нернста, 
Следовательно, реакция в рассматриваемой системе идет в направлении:
H3AsO4 + 2I- + 2H+ ↔ H3AsO3 + I2 + H2O
Константа равновесия реакции
Согласно ЗДМ,
Отсюда находим х = 0,0085. Тогда [I¯] = 0,017 M; [H3AsO4] = 0,059 M; [H3AsO3] = [I2] = 0,141M; [H+] ≅ 10 M.
Решение. В соответствии с уравнением Нернста для редокс-пары Cu2+/Cu+ потенциал реакционной системы будет определяться растворимостью CuI (Ks = 1,1×10-12), поскольку йодид-ион взят в избытке по отношению к иону одновалентной меди. Рассчитываем равновесную концентрацию иона Cu+ в системе:
Согласно ЗДМ, Ks,CuI = x(0,4 -(0,1-x)) ≅ 0,3х = 1,1×10-12. Отсюда следует х = [Cu+] = 3,6×10-12 M. Теперь вычисляем потенциалы редокс-пар:
Следовательно, реакция пойдет по направлению 2Cu2+ + 4I- → 2CuI↓ + I2.
Решение. Стандартный потенциал пары Cu2+/CuBr равен:
откуда
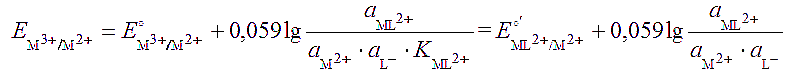
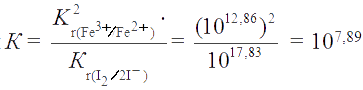
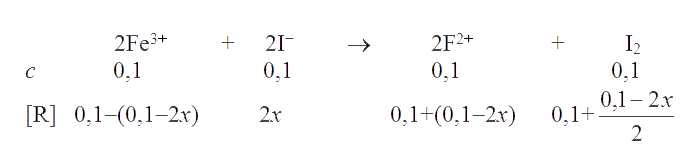
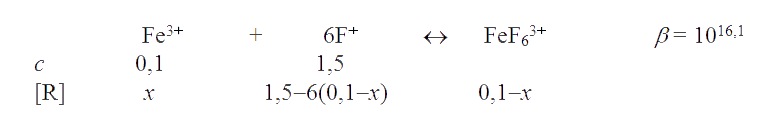
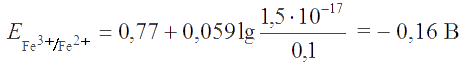
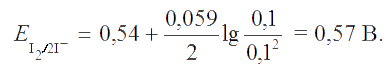
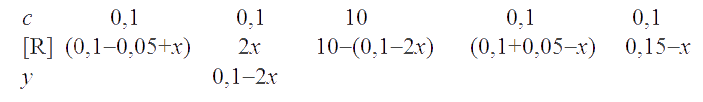
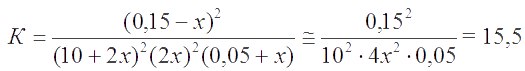
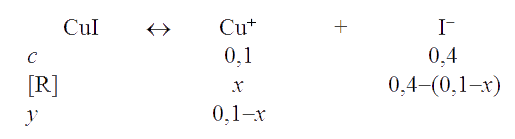
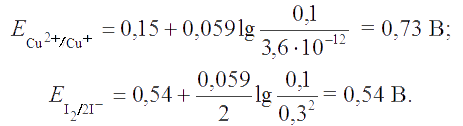
.PNG)