Процесс растворения сульфидов металлов в азотной кислоте можно представить в виде следующей системы равновесий:
Константа равновесия реакции растворения .
Если К >> 1, то за неизвестное (х) принимают остаточную концентрацию ионов водорода, умноженную на 8п. Равновесные концентрации остальных реагентов выражают через х, а их начальные концентрации, как указано в примере 4 раздела 1.5. Затем с помощью константы К рассчитывают х, аналогично тому, как это делается при растворении металлов в азотной кислоте.
Если К << 1, то за неизвестное принимают концентрацию иона металла, умноженную на 3т. В остальном поступают так же, как при растворении металлов в HNO3, принимая во внимание, что величина [NO] может быть меньше реальной растворимости NO в воде (пример 54).
Решение. Описываем систему равновесий для данной задачи (m = n = 1):
Константа равновесия реакции растворения
Согласно ЗДМ, 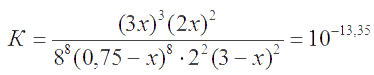
.PNG)
.PNG)
.PNG)