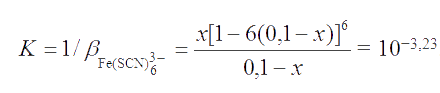Количественной характеристикой силы окислителя или восстановителя является окислительно-восстановительный потенциал Е. Чем больше Е, тем больше сила окисленной формы и меньше сила восстановленной формы полуреакций.
Потенциал, измеренный относительно потенциала стандартного водородного электрода (принятого равным нулю) при выполнении условий aOx = aRed = aH+= 1 M, называется стандартным потенциалом и обозначается символом E°. Он связан с константой Кr редокс-перехода (5.1) уравнением
Константа равновесия редокс-реакции зависит от стандартных потенциалов редокс-пар, участвующих в реакции, согласно уравнению
В нестандартных условиях потенциал Е зависит от активностей окисленной и восстановленной форм элемента и выражается уравнением Нернста
где R - газовая постоянная, равная 8,314 Дж/моль×К; F - постоянная Фарадея, равная 96490 Кл/моль. Вместо натурального логарифма удобнее пользоваться десятичным. Целесообразно также вычислить величину 2,303 RT/F. При стандартной температуре 25°С получают 0,059. Поэтому уравнение Нернста обычно записывают так:
Если в редокс-переходе участвуют ионы водорода или гидроксила, то потенциал Е будет зависеть и от их концентрации в растворе. В случае редокс-перехода
величина Е равна
.PNG) . . |
(5.2) |
При aOx = aRed = aH+= 1 M величина Е = E°Ox/Red.
Если в качестве полуэлемента используется электрод из металла, погруженный в раствор, содержащий одноименные ионы, например медный электрод в растворе CuSO4, то потенциал пары Mz+ + zē ↔ M будет равен
.PNG)
Помимо рН раствора на величину потенциала оказывает влияние ионная сила раствора. С учетом обоих факторов уравнение Нернста удобно представить в виде
.PNG)
где
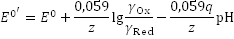
– формальный (реальный) потенциал, являющийся константой только при постоянных температуре, ионной силе и рН среды (q - показатель степени, в которой концентрация ионов Н+ входит в уравнение редокс-перехода) (пример 48).
Если в растворе одна из форм связана в комплекс или малорастворимое соединение, то потенциал системы также изменится, поскольку концентрация иона в свободном состоянии уменьшится (пример 49). В таком случае постоянство концентраций частиц, реагирующих с компонентами редокс-пар с образованием комплексных соединений, является дополнительным условием для того, чтобы формальный потенциал являлся константой.
Для редокс-перехода Mz+ + zē ↔ M зависимость электродного потенциала от концентрации иона металла с учетом ионной силы и рН раствора имеет вид
.PNG)
Решение. Для полуреакции H3AsO4 + 2ē + 2H+ ↔ HAsO2 + 2H2O, используя уравнение (5.2) в концентрационной форме, получаем
Решение. Вычисляем концентрацию не связанного в тиоцианатный комплекс иона Fe3+ , используя равновесие для насыщенного комплекса
Константа данного равновесия является обратной константой устойчивости комплекса, т.е.
Примем, что (0,1 - х) ≅ 0,1. Тогда имеем: 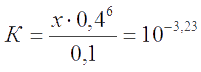
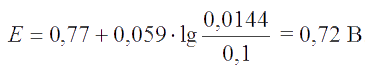
Окислительные свойства железа (III) в присутствии тиоционата аммония ослабляются, а восстановительные свойства железа (II), наоборот, усиливаются.
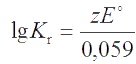
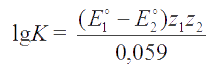
.PNG)
.PNG)
.PNG)
.PNG)