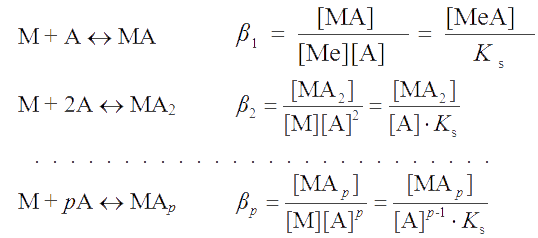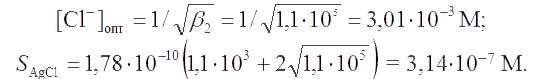Комплексообразующими свойствами по отношению к катиону осадка может обладать его собственный анион. При большом избытке аниона-осадителя это приводит к увеличению растворимости осадка вследствие образования растворимых комплексных соединений. Например, AgCl + 3Cl¯ ↔ AgCl43−. В избытке осадителя растворяются, главным образом, бинарные осадки состава 1:1.
При взаимодействии осадка МА с осадителем-комплексантом A возможно возникновение следующих равновесий комплексообразования:
Равновесную концентрацию недиссоциированных молекул МА в растворе называют собственной растворимостью осадка S°. Как видно из выражения для β1, S° = β1×Ks. Если температура и ионная сила раствора неизменны, то величина S° также постоянна. Согласно условию материального баланса растворимость осадка будет складываться из равновесных концентраций всех частиц, содержащих катион осадка, т.е.
| SMA = [M] + [MA] + [MA2] + . . . + [MAр]. | (4.1) |
Выразив концентрации частиц в этом уравнении через ступенчатые суммарные константы устойчивости βi и произведение растворимости осадка, получим
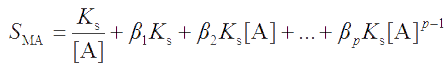 |
(4.2) |
или в компактной форме
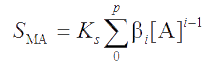 |
(4.3) |
(при i = 0 константа β0 = 1).
Растворимость осадка MAn рассчитывают по аналогичной формуле:
| (4.4) |
Растворимость осадка еще более сложного состава (MmAn) можно вычислить по формуле
| (4.5) |
причем в большинстве случаев собственной растворимостью осадка S° допустимо пренебречь ввиду ее малости по сравнению со вкладом других частиц в общую растворимость осадка. (При m = 1 собственная растворимость S° является одним из слагаемых под знаком суммы.)
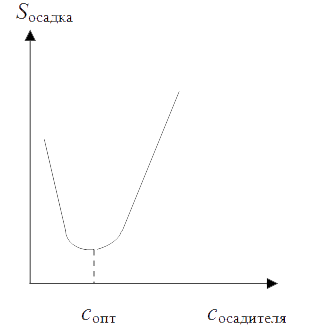
Важным для практических целей является создание условий, обеспечивающих минимальную растворимость осадка в избытке комплексанта-осадителя (рис. 2). Она наблюдается в тот момент, когда уменьшение растворимости осадка под воздействием одноименного иона уравновешивается увеличением его растворимости за счет процесса комплексообразования. Эту минимальную растворимость можно найти, если продифференцировать уравнение (4.5) по концентрации осадителя и приравнять полученное выражение к нулю.
Тогда оптимальная концентрация осадителя [A-]опт, обеспечивающая минимальную растворимость осадка типа MnAm, находится решением уравнения
 , , |
(4.6) |
Например, если осадок МА растворяется в избытке аниона-осадителя с образованием комплексов состава не выше МА2, то, согласно (4.3), его растворимость будет равна:
Затем, согласно уравнению (4.6), находим оптимальную концентрацию аниона-осадителя (пример 46), при которой растворимость осадка MA будет минимальной:
 , , |
(4.7) |
откуда . Тогда минимальная растворимость осадка MA при оптимальной концентрации выразится уравнением
| (4.8) |
По формуле (4.4) можно рассчитать также растворимость осадков амфотерных гидроксидов в избытке щелочи:
где βi - суммарные ступенчатые константы устойчивости образующихся гидроксокомплексов металла.
Рис. 2. Зависимость растворимости осадка от избыточной концентрации осадителя-комплексанта
Кривая растворимости осадка показывает, что минимальная растворимость осадка наблюдается при строго определенной концентрации осадителя (сопт) в тот момент, когда кривая проходит через точку минимума.
Решение. Сопоставление констант устойчивости хлоридных комплексов серебра дает основание предположить, что повышенная растворимость осадка обусловливается в основном образованием комплекса AgCl2-. Поэтому в первом приближении минимальную растворимость осадка AgCl можно определить, пренебрегая вкладом в нее частиц AgCl32- и AgCl43-. Тогда, согласно уравнениям (4.7) и (4.8),