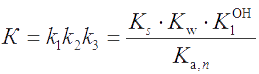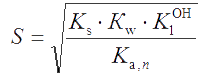Как анион, так и катион малорастворимого соединения могут взаимодействовать с молекулами растворителя с протеканием реакций протолиза анионов слабых кислот и катионов слабых оснований, что приводит к увеличению растворимости осадка. Математическое описание растворимости осадков в их насыщенном растворе с учетом всех стадий протолиза в общем случае очень сложное. Однако в большинстве случаев учет протолиза лишь по первой ступени позволяет получить вполне удовлетворительные результаты.
Гидратированные катионы в водных растворах подвергаются ступенчатому протолизу по схеме
;
и т.д.
Эти реакции можно рассматривать и как процесс образования гидроксокомплексов:
.PNG)
Выразим константу K суммарного равновесия процесса растворения малорастворимого соединения МА с учетом протолиза катиона по первой ступени:
| МА ↔ Мn+ + Аn- | k1 = Ks |
| Н2О ↔ Н+ + ОН¯ | k2 = Kw |
| Mn+ + OH¯ ↔ M(OH)(n-1)+ | k3 = K1OH |
| MA + H2O ↔ M(OH)(n-1)+ + An- + H+, | (3.5) |
| K = k1· k2 · k3 = Ks · Кw· K1OH , | (3.6) |
(K1OH - константа образования гидроксокомплекса M(OH)(n-1)+, равная последней обратной константе диссоциации гидроксокомплекса М(ОН)n , т.е. K1OH = 1/Kb,n).
Константу суммарного равновесия процесса растворения осадка с учетом протолиза аниона по первой ступени получим, принимая во внимание следующие реакции:
| MA ↔ Mn+ +An- | k1 = Ks |
| An- + H2O ↔ HA(n-1)- + OH¯ | k2 = KW/Ka.n |
MA + H2O ↔ Mп+ + HA(п-1)- + OH¯
Константа равновесия этой реакции .
Суммарное равновесие реакции растворения соли МА, когда протолизу по первой ступени подвергаются одновременно анион и катион, можно получить рассмотрением системы частных равновесий и соответствующих констант:
| МА ↔ Мn+ + Аn- | k1 = Ks |
| Аn- + Н2О ↔ A(n-1)- + ОН¯ | k2 = KW/Ka.n |
| Mn+ + OH¯ ↔ [M(OH)](n-1)+ | k3 = K1OH |
MA + H2O ↔ [M(OH)](n-1)+ + HA(n-1)-
При расчете равновесия реакции растворения с учетом процессов протолиза ионов малорастворимой соли слабой кислоты можно сделать следующие допущения:
1. Анион Аn- практически полностью переходит в частицу НА(n-1)-, так что концентрацией [Аn-] по сравнению с [НА(n-1)-] можно пренебречь (аналогичное допущение справедливо и при образовании гидроксокомплексов катиона).
2. Вследствие малой растворимости соли концентрация ионов ОН¯ или ионов Н+ определяется диссоциацией воды и рН равно 7. Эти допущения оправданы при условии, что Ka,n < 10−7 (K1OH > 107).
Уравнение для расчета растворимости малорастворимой соли МА с учетом лишь протолиза катиона можно получить, вернувшись к рассмотрению реакции растворения (3.5). Для этой реакции равновесные концентрации продуктов растворения равны [M(OH)(n-1)+] = [An-] = [H+] = S.
С учетом этих концентраций константа равновесия реакции растворения, согласно ЗДМ, выразится в виде
| (3.7) |
Тогда и, согласно (3.6),
. В предположении, что [H+] = 10-7 M, из уравнения (3.7) вытекает более простая зависимость K = 10-7 · S2, откуда
. Учитывая при этом выражение (3.6), получаем формулу для расчета растворимости соли МА в условиях протолиза катиона:
.
Аналогичным образом можно получить уравнение для расчета растворимости соли МА с учетом протолиза аниона (пример 31)
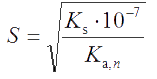 , , |
(3.8) |
и уравнение, когда протолизу подвергаются одновременно катион и анион соли:
Решение. Для реакции растворения сульфида кадмия
CdS + H2O ↔ Cd2+ + HS− + OH−
константа равновесия K = KS · KW/Ka,2. Поскольку для сероводородной кислоты Ка,2 = 1,2×10-15 < 10-7, то, согласно (3.8), с достаточным приближением растворимость CdS равна 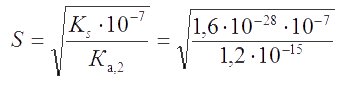
Без учета протолиза аниона = 1,26×10-14 M. Протолиз аниона приводит к увеличению растворимости CdS (на 4 порядка).