Чтобы найти условия получения максимальной буферной емкости, рассмотрим уравнение (2.19). Учитывая, что dcOH¯= dcA¯ = dcHA, имеем
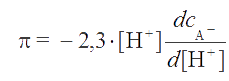 . . |
(2.22) |
Из выражения 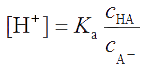
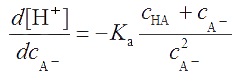 . . |
(2.23) |
Подставляя (2.23) в (2.22), приходим к выражению 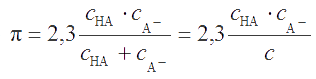
В точке максимума функции π = f(cA¯) производная dπ/dcA¯ = 0, что выполняется, если cHA = cA¯ =c / 2. Следовательно максимальная емкость буферного раствора имеет место при равной концентрации его компонентов. Для определенного соотношения cHA/cA¯ буферная емкость пропорциональна общей концентрации с.
Поскольку, согласно уравнению (2.20), величина π зависит также от рН, можно дифференцированием уравнения (2.21) и приравниванием к нулю производной dπ/d[H+] показать, что при условии
| cHA = cA¯ , | (2.24) |
максимальная буферная емкость πmax достигается, когда
| [H+] = Ka . | (2.25) |
Произведя эту замену в уравнении (2.21), получаем выражение для расчета максимального значения буферной емкости раствора, состав которого удовлетворяет условиям (2.24) и (2.25):
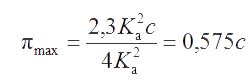 |
(2.26) |
Соотношение cHA/cA¯ обычно находится в пределах от 10:1 до 1:10, так что область буферного действия охватывает значения рН = рКа ± 1. Рецептуры приготовления буферных растворов для разных интервалов рН можно найти в справочных руководствах или составить буферные смеси самим (пример 26).
Решение. Подходящими буферными парами могут быть, например, две следующие пары: 1) NH4+, NH3 (pKNH4+ = pKw - pKNH3= 14 – 4,8 = 9,2; KNH4+ = 6,3·10-10; 2) HCO3- , CO32- (pKHCO3¯ = 10,32).
Рассчитаем состав буферного раствора для пары NH4+, NH3. Согласно (2.15), .PNG)
Решая систему уравнений
находим концентрации компонентов буферного раствора: cNH4Cl = 0,1 М; cNH3 = 0,63 М.
.PNG)
.PNG)