Способность буферных растворов противостоять воздействию сильных кислот и оснований на величину рН среды количественно оценивается буферной емкостью растворов. Буферной емкостью называют количество сильной кислоты или основания определенной концентрации, которое можно добавить к 1 л буферного раствора, чтобы значение рН его изменилось только на единицу. Таким образом, буферная емкость 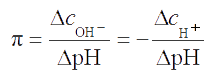
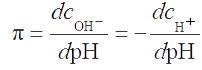
Предположим, что к буферному раствору, содержащему смесь кислоты НА и сопряженного основания А¯ (соли этой кислоты), прибавлено некоторое количество сильного основания, т.е. ионов ОН¯, причем начальная концентрация этих ионов в растворе равна cOH¯. При этом бóльшая часть добавленных ионов ОН¯ прореагирует с кислотой НА по реакции НА + ОН¯ ↔ А¯+Н2О.
Начальную концентрацию cOH¯ можно выразить как cOH− = [A‾] + [OH¯] - [H+], где [OH¯] - [H+] - та часть концентрации ионов [OH¯], которая не вступила в реакцию с НА. (Она равна избыточной концентрации ионов [OH-] над их концентрацией, получающейся в результате диссоциации воды.)
Пусть общая концентрация компонентов буферной пары равна: с = [HA] + [A-]. При введении сильного основания или сильной кислоты в буферный раствор она не изменяется, поскольку добавление dcOH− моль сильного основания на 1 л раствора вызывает увеличение dcA− аналитической концентрации А- и такое же уменьшение аналитической концентрации НА, т.е. dcA- = dcHA. Из уравнения для константы буферной пары (т.е. константы диссоциации кислоты НА) выразим 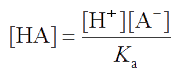
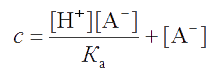
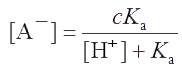
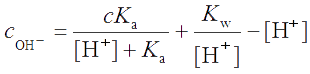
Продифференцируем полученное уравнение по d[H+]:
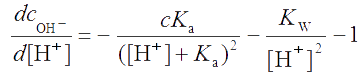 . . |
(2.18) |
Преобразуем выражение для буферной емкости π:
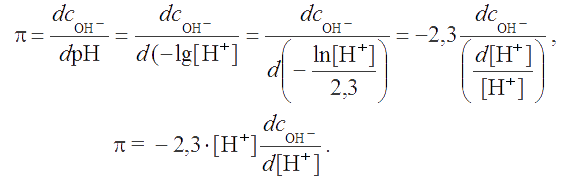 |
(2.19) |
Подставляя (2.18) в (2.19), находим
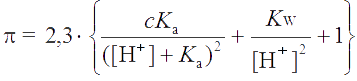 . . |
(2.20) |
Буферная емкость раствора зависит от общей концентрации компонентов буферной пары с. Чем больше с, тем больше буферная емкость раствора. При постоянной суммарной концентрации с величина π зависит от рН раствора.
В аналитической практике с >> [H+], c >> Кw и уравнение (2.20) упрощается:
 . . |
(2.21) |