Основы теории координационной связи заложены в 1893 г. Альфредом Вернером. В этой теории на первый план выдвигается принцип координации: координационный ион или атом металла окружен противоположно заряженными ионами или нейтральными молекулами, образуя при этом геометрически правильную структуру.
Комплексными соединениями называют вещества, в состав которых входят комплексные ионы (катионы или анионы), ион металла или кислотного остатка. Например, K4[Fe(CN)6], [Ag(NH3)2]Cl, [Ni(H2O)6]Cl2.
В формулах комплексных соединений различают внутреннюю и внешнюю сферы, причем внутреннюю сферу выделяют квадратными скобками и называют координационной.
Внутренняя сфера состоит из центрального атома, который называют комплексообразователем, и лигандов, координированных вокруг центрального атома. Лигандами могут быть анионы и молекулы, они ковалентно связаны с центральным атомом. Число σ-связей, образуемых центральным атомом с лигандами, называют координационным числом комплексообразователя.
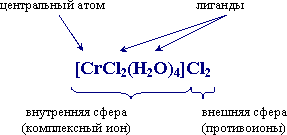
Комплексный катион
[Ni(NH3)6]Cl2 - [Ni(NH3)6]2+ – внутренняя сфера; Cl- – внешняя сфера; Ni2+ – комплексообразователь или центральный атом; NH3 – лиганд; 6 – координационное число.
Внутренняя сфера комплексного соединения может состоять из катионов, если комплексный ион заряжен положительно, или анионов, если комплексный ион заряжен отрицательно, а также может быть нейтральной, если заряд комплекса равен нулю.
Комплексный анион
Например, K4[Fe(CN)6] - [Fe(CN)6]4- – внутренняя сфера; К+ – внешняя сфера; Fe2+ – комплексообразователь или центральный атом; CN- – лиганд; 6 – координационное число.
Например, K4[Fe(CN)6] - [Fe(CN)6]4- – внутренняя сфера; К+ – внешняя сфера; Fe2+ – комплексообразователь или центральный атом; CN- – лиганд; 6 – координационное число;
Нейтральный комплекс
[Pt(NH3)2Cl4] - [Pt(NH3)2Cl4]0 – внутренняя сфера; внешняя сфера отсутствует; Pt4+ – комплексообразователь; NH3; Cl- – лиганды; 6 – координационное число (2+4).
[Pt(NH3)2Cl4] - [Pt(NH3)2Cl4]0 – внутренняя сфера; внешняя сфера отсутствует; Pt4+ – комплексообразователь; NH3; Cl- – лиганды; 6 – координационное число (2+4).