Ионная связь образуется в результате электростатического притяжения ионов противоположного знака. Способность элементов образовывать простые ионы обусловлена электронной структурой их атомов. Эта способность оценивается энергией ионизации и сродством к электрону. Катионы легче всего образуют элементы с малыми значениями энергии ионизации – щелочные и щелочно-земельные металлы. Анионы легче всего образуют р-элементы VII группы, так как они обладают наибольшим сродством к электрону. Поэтому ионные соединения легче всего образуют s-элементы I и II групп периодической системы с галогенами. Однако и в этом случае электронная плотность между ионами не равна нулю, поэтому говорят лишь о преимущественном проявлении ионной связи.
Объединение катионов и анионов в ионный кристалл осуществляется благодаря кулоновскому притяжению электрических зарядов. В молекуле 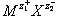 заряды взаимодействуют с силой
заряды взаимодействуют с силой 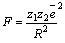 . Величина R – расстояние между двумя ионами. Если это расстояние будет бесконечно далеко, то сила равна нулю. На конечном расстоянии сила взаимодействия двух противоположно заряженных ионов отрицательна, что соответствует притяжению, ионы стремятся сблизиться на минимально допустимое расстояние, которое соответствует устойчивому связанному состоянию. Сила взаимодействия двух одинаково заряженных ионов положительна, что соответствует отталкиванию. Ионы стремятся разлететься и на любом расстоянии не образуют устойчивого соединения. Таким образом, энергия образования кристалла должна быть отрицательной. Такое условие реализуется при образовании ионного кристалла.
. Величина R – расстояние между двумя ионами. Если это расстояние будет бесконечно далеко, то сила равна нулю. На конечном расстоянии сила взаимодействия двух противоположно заряженных ионов отрицательна, что соответствует притяжению, ионы стремятся сблизиться на минимально допустимое расстояние, которое соответствует устойчивому связанному состоянию. Сила взаимодействия двух одинаково заряженных ионов положительна, что соответствует отталкиванию. Ионы стремятся разлететься и на любом расстоянии не образуют устойчивого соединения. Таким образом, энергия образования кристалла должна быть отрицательной. Такое условие реализуется при образовании ионного кристалла.