В основе современной теории строения атома лежат следующие основные положения:
- электрон имеет двойственную (корпускулярно-волновую) природу;
- для электрона невозможно одновременно точно измерить координату и скорость (принцип неопределенности);
- электрон в атоме не движется по определенной траектории, а может находиться в любой части около ядерного пространства.
Двойственная природа электрона
Решающий шаг в развитии квантовой теории строения атома был сделан в 1924 г. французским физиком Луи де Бройлем, когда он высказал предположение, что электрону следует приписать некоторую длину волны. Было уже известно, что электромагнитное излучение способно обнаруживать свойства, как волновые, так и корпускулярные, подобные свойствам частиц. В последнем случае излучение ведет себя как поток частиц – фотонов. Энергия фотона Е связана с его длиной волны l или частотой n соотношением:
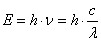 ,
,где с – скорость света. Пользуясь уравнением Эйнштейна Е = mc2, находим:
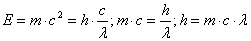 .
.Де Бройль предположил, что аналогичное уравнение можно записать для электрона. Уравнение де Бройля имеет вид:
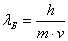 ,
,где lБ – длина волны электрона, m и v – его масса и скорость. Это уравнение легло в основу квантовой теории.
Де Бройль предложил рассматривать электрон как стоящую волну, которая должна умещаться на круговой атомной орбите. Этим определяется требование к длине волны электрона – она должна уложиться на орбите целое число раз.
В 1927 г. наличие волновых свойств у электрона экспериментально подтвердили опыты Девиссона, Джермера и Томсона. Они обнаружили, что пучок электронов, подобно пучку света, испытывает дифракцию, проходя через кристалл либо металлическую фольгу.