Лабораторная работа № 1
Тема: Определение молярной массы оксида углерода (IV).
Реактивы: мрамор CaCO3, соляная кислота HCl (ω (HCl) = 10 % (масс.)), раствор серной кислоты (ω (H2SO4) = 96 % (масс.)), дистиллированная вода.
Посуда и оборудование: аппарат Киппа, две склянки Тищенко, соединительные и газоотводные трубки, весы технохимические или электронные, мерный цилиндр на 500 мл, колба с пробкой на 250-500 мл, карандаш для письма по стеклу, термометр, барометр.
Порядок выполнения работы
Экспериментальное определение молярной массы газа основано на измерении массы известного объема газа, приведенного к нормальным условиям.
Для получения и очистки углекислого газа необходимо собрать установку, состоящую из аппарата Киппа, заряженного кусочками мрамора и 10%-ной (масс.) соляной кислотой, промывной склянки Тищенко с водой для удаления примеси хлороводорода в газе и промывной склянки с концентрированной серной кислотой для осушки оксида углерода (IV) (рис. 85).
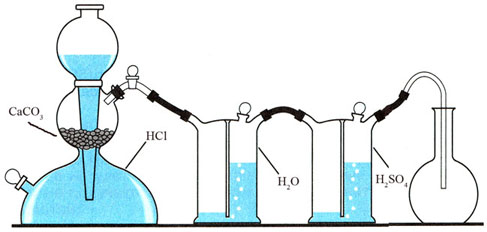 |
Рис. 85. Прибор для получения и очистки оксида углерода (IV) |
1. Сухую колбу закройте резиновой пробкой, отметьте положение нижнего края пробки карандашом для надписей по стеклу.
2. Взвесьте колбу на весах с точностью не более 0,01 г.
3. Заполните колбу оксидом углерода (IV) из аппарата Киппа. Для этого опустите газоотводную трубку до дна колбы, откройте кран аппарата и в течение 5-7 минут пропускайте умеренный ток газа. Полноту заполнения колбы проверьте горячей лучиной, поднеся её к горлу колбы.
4. После заполнения колбы углекислым газом закройте её пробкой до метки и взвесьте на весах.
5. Опыт повторите до совпадения результатов 2 измерений.
6. Определите объем газа при данных условиях. Для этого заполните колбу водой до черты, отмеченной на горле, и измерьте объем воды мерным цилиндром.
7. Запишите показания барометра и термометра.
8. Результаты измерений занесите в таблицу:
|
Масса колбы с пробкой и воздухом m1, г |
|
|
Масса колбы с пробкой и оксидом углерода (IV) m2, г |
|
|
Объем газа, равный объему воды в колбе V, мл |
|
|
Температура Т, °С |
|
|
Давление, Р, мм рт.ст. |
|
9. Вычислите молекулярную массу оксида углерода (IV):
- приведите объем углекислого газа к нормальным условиям, используя уравнение объединенного газового закона:
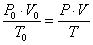 ,
,
где Р0 – давление при нормальных условиях, равное 760 мм рт.ст.; V0 – объем газа при нормальных условиях, л; Т0 – температура при нормальных условиях, равная 273 К; Р – атмосферное давление, мм рт.ст., Т – температура, К; V – объем газа, л;
- вычислите массу воздуха в колбе (m3), зная, что масса 1 л воздуха при нормальных условиях равна 1,293 г;
- вычислите массу пустой колбы с пробкой (m4): m4 = m1 – m3;
- вычислите массу углекислого газа в колбе (m5): m5 = m2 – m4;
- определите абсолютную плотность углекислого газа (r(СО2)): 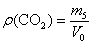 ;
;
- рассчитайте относительную плотность углекислого газа по воздуху (Dвозд.): 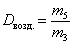 ;
;
- вычислите молярную массу оксида углерода (IV):
а) по значению абсолютной плотности: М1 = 22,4·ρ(СО2), где 22,4 моль/л – молярный объем газа при нормальных условиях;
б) по значению относительной плотности: М2 = 29·Dвозд(СО2), где 29 г/моль – молярная масса воздуха;
в) используя уравнение Менделеева–Клайперона: 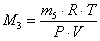 , где R – универсальная газовая постоянная равная 8,31 Дж/(моль·К); Т – абсолютная температура, К; Р – давление, Па; V – объем газа, м3;
, где R – универсальная газовая постоянная равная 8,31 Дж/(моль·К); Т – абсолютная температура, К; Р – давление, Па; V – объем газа, м3;
- по полученным данным рассчитайте среднее значение молярной массы, М, г/моль.
10. Вычислите абсолютную и относительную погрешность определения молярной массы углекислого газа:
- абсолютная погрешность опыта (ΔM) представляет собой разность между истинным значением молярной массы и полученной опытным путем: ΔМ = |Mист. – М|;
- относительная погрешность определения равна отношению абсолютной погрешности к истинному значению, выраженная в %: 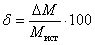 .
.
Рекомендуемая литература
1. Глинка Н.Л. Общая химия. – М.: Химия, 2003.
2. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. – М.: Химия, 1994.