Частицы растворенного вещества и растворителя находятся в беспорядочном тепловом движении и равномерно распределены по всему объему раствора. Движение частиц может стать направленным, если привести в соприкосновение два раствора разных концентраций.
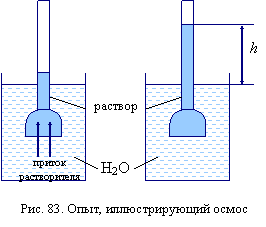 Рассмотрим это движение частиц на примере (рис. 83). Поместим в сосуд с растворителем емкость с раствором, отделенным от чистого растворителя полупроницаемой перегородкой (непроницаемой для молекул растворенного вещества и проницаемой лишь для молекул растворителя). Из-за разности концентраций молекулы растворителя через полупроницаемую перегородку будут переходить в раствор, и объем раствора будет увеличиваться за счет притока растворителя, а его концентрация уменьшаться. Это явление называется осмосом. Столб жидкости h образовался за счет осмоса. Осмос прекратится при выравнивании концентраций. Осмос можно подавить, если создать в сосуде с раствором избыточное давление, это и есть давление столба жидкости h.
Рассмотрим это движение частиц на примере (рис. 83). Поместим в сосуд с растворителем емкость с раствором, отделенным от чистого растворителя полупроницаемой перегородкой (непроницаемой для молекул растворенного вещества и проницаемой лишь для молекул растворителя). Из-за разности концентраций молекулы растворителя через полупроницаемую перегородку будут переходить в раствор, и объем раствора будет увеличиваться за счет притока растворителя, а его концентрация уменьшаться. Это явление называется осмосом. Столб жидкости h образовался за счет осмоса. Осмос прекратится при выравнивании концентраций. Осмос можно подавить, если создать в сосуде с раствором избыточное давление, это и есть давление столба жидкости h.
Величина давления, которую надо создать, чтобы предотвратить диффузию растворителя через полупроницаемую перегородку, называется осмотическим давлением p.
Осмотическое давление тождественно гидростатическому давлению столба жидкости высотой h. Зависит от температуры, концентрации и не зависит от природы растворителя и растворенного вещества.
При малых концентрациях растворенного вещества, то есть в условиях, близких к идеальным растворам, осмотическое давление определяется уравнением Вант-Гоффа:
где СМ – молярная концентрация растворенного вещества; R – универсальная газовая постоянная; Т – абсолютная температура.
Все приведенные выше законы справедливы только для идеальных растворов, не существующих в обычных условиях. Однако их можно использовать для реальных растворов, введя поправку на неидеальность. Эта поправка называется изотоническим коэффициентом i и равна отношению реально наблюдаемой величины того или иного свойства к рассчитанной при условии идеальности раствора:
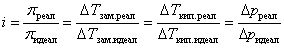 .
.Это отклонение может быть вызвано как взаимодействием частиц в растворе, так и распадом растворенного вещества на ионы. То, что для многих растворов электролитов величина i > 1, является прямым доказательством электролитической диссоциации.
