 9.2. Стандартный окислительно-восстановительный потенциал.
9.2. Стандартный окислительно-восстановительный потенциал.Направление протекания окислительно-восстановительных реакций
В окислительно-восстановительном процессе всегда участвуют две сопряженные пары, каждая из которых включает окислитель и восстановитель:
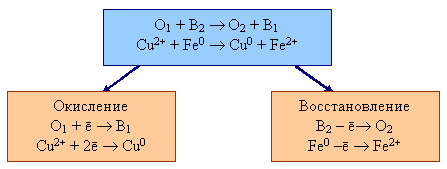
В первой паре Cu2+ является окислителем (О1), а Cu0 – восстановителем (В1), во второй паре окислитель (О2) – Fe2+, а восстановитель (В2) – Fe0. Нельзя провести окисление без восстановления, и наоборот; эти два процесса разделить в пространстве невозможно.
Если в раствор соли металла, например, меди, поместить пластинку из меди, то установится равновесие:

 Cu0 (тв.).
Cu0 (тв.).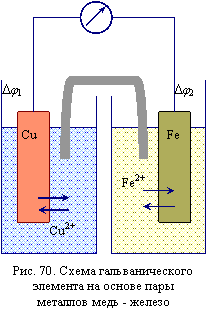 Реакции образования ионов меди способствует увеличение энтропии системы. В состоянии равновесия на пластинке локализуется положительный заряд, который компенсируется противоионами, находящимися в растворе. Так возникает двойной электрический слой, который характеризуется скачком потенциала Δφ1. Величина Δφ1 зависит от природы металла, температуры и концентрации ионов металла в растворе, её нельзя измерить и рассчитать.
Реакции образования ионов меди способствует увеличение энтропии системы. В состоянии равновесия на пластинке локализуется положительный заряд, который компенсируется противоионами, находящимися в растворе. Так возникает двойной электрический слой, который характеризуется скачком потенциала Δφ1. Величина Δφ1 зависит от природы металла, температуры и концентрации ионов металла в растворе, её нельзя измерить и рассчитать.
Однако если такой полуэлемент соединить проводником с другим полуэлементом, например, Fe2+ (р.) + 2
 Fe0 (тв.), Δφ2, то между ними будет протекать электрический ток, обусловленный разностью потенциалов (рис. 70). Получим гальванический элемент (модель).
Fe0 (тв.), Δφ2, то между ними будет протекать электрический ток, обусловленный разностью потенциалов (рис. 70). Получим гальванический элемент (модель).
Электродвижущая сила (Е) процесса:
 Cu0 + Fe2+
Cu0 + Fe2+будет равна разности потенциалов полуэлементов:
Электродвижущую силу измерить можно. Поэтому для характеристики полуэлементов используют величину ЭДС между данным полуэлементом и электродом сравнения.
За электрод сравнения принят стандартный водородный электрод.
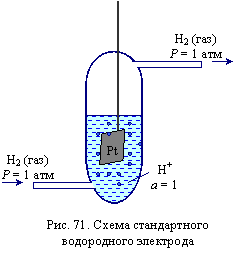 Стандартный водородный электрод состоит из платиновой черни, опущенной в раствор кислоты с активностью ионов водорода, равной 1 (а ≈ С = 1 моль/л). Платиновая пластинка находится под током газообразного водорода, подаваемого под давлением 1,013·105 Па (1 атм) при постоянной температуре.
Стандартный водородный электрод состоит из платиновой черни, опущенной в раствор кислоты с активностью ионов водорода, равной 1 (а ≈ С = 1 моль/л). Платиновая пластинка находится под током газообразного водорода, подаваемого под давлением 1,013·105 Па (1 атм) при постоянной температуре.
Условно принято считать, что Δφ0 = 0 для процесса:

 Н20.
Н20.ЭДС цепи, составленной из стандартного водородного электрода и изучаемого электрода, называют электродным потенциалом последнего. Если концентрации ионов равны единице, то этот потенциал называют стандартным электродным потенциалом. Для окислительно-восстановительной пары Cu2+/Cu0, при [Cu2+] = 1 моль/л:
или в общем виде:
где Еок – электродный потенциал пары, выступающей в качестве окислителя; Евос – электродный потенциал пары, выступающей в качестве восстановителя.