1. Используя справочные данные, вычислите тепловые эффекты следующих реакций:
- 2MgO (тв.) + CO2 (г.) = 2MgO (тв.) + C (тв.);
- MnO2 (тв.) + 2C (тв.) = 2CO (г.) + Mn (тв.);
- 4FeS2 (тв.) + 11O2 (г.) = 2Fe2O3 (тв.) + 8SO2 (г.);
- 2NH3 (г.) + 1,5O2 (г.) = N2 (г.) + 3H2O (ж.);
- H2O (г.) + CO (г.) = CO2 (г.) + H2 (г.);
- H2S (г.) + 1,5O2 (г.) = H2O (ж.) + SO2 (г.).
2. Теплота растворения безводного сульфата меди (II) составляет -66,1 кДж/моль, а теплота перехода CuSO4 в CuSO4·5H2O равна -78,8 кДж/моль. Вычислите теплоту растворения пентагидрата сульфата меди (II).
3. Исходя из значений изменения энтальпий реакций окисления оксида мышьяка (III) кислородом и озоном, вычислите энтальпию образования озона из молекулярного кислорода:
As2O3 (тв.) + O2 (г.) = As2O5 (тв.), ΔH1 = -271 кДж/моль;
As2O3 (тв.) + 2/3 O3 (г.) = As2O5 (тв.), ΔH2 = -365 кДж/моль.
4. Используя приведенную диаграмму, выразите ΔН реакции взаимодействия водорода с кислородом через ΔН отдельных стадий:
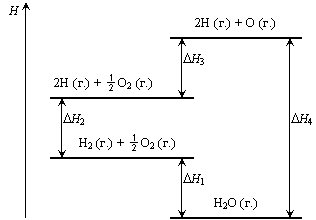
5. Используя значения стандартных энтальпий образования ряда оксидов, сравните их по термодинамической устойчивости:
|
Оксид |
B2O3
|
Al2O3
|
Ga2O3
|
In2O3
|
Tl2O3
|
|
|
-1254,0
|
-1667,0
|
-1089,0
|
-925,9
|
-390,4
|
6. Используя справочные данные, рассчитать изменение энтропии при стандартных условиях для следующих реакций:
- MgO (тв.) + H2 (г.) = Mg (тв.) + H2O (г.);
- C (графит) + CO2 (г.) = 2CO (г.);
- FeO (тв.) + CO (г.) = Fe (тв.) + CO2 (г.).
7. Для реакции H2 (г.) + F2 (г.) = 2HF (г.) в стандартных условиях изменение энтальпии равно -268,99 кДж/моль, изменение энтропии составляет 6,87 Дж/(моль·К). Вычислите изменение стандартной энергии Гиббса для данной реакции.
8. Используя справочные данные, определите термодинамическую возможность протекания в стандартных условиях следующих реакций:
- 2Al (тв.) + 3/2 O2 (г.) = Al2O3 (тв.);
- NH4NO3 (тв.) = N2O (г.) + 2H2O (г.);
- Ba(OH)2 (тв.) + CO2 (г.) = BaCO3 (тв.) + H2O (ж.).
9. Определите направление реакции Cl2 (г.) + 2I- (р-р.) 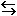 2Cl- (р-р.) + I2 (тв.), если известно, что
2Cl- (р-р.) + I2 (тв.), если известно, что 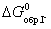 = -50,28 кДж/моль и
= -50,28 кДж/моль и 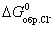 = -131,57 кДж/моль.
= -131,57 кДж/моль.
10. Вычислите температуру, выше которой термодинамически возможен процесс самопроизвольного разложения метана на простые вещества.
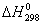 , кДж/моль
, кДж/моль