Понятие энтропии
Энтропия (S) – функция состояния системы, такая же фундаментальная и универсальная, как энергия. В классической термодинамике под энтропией понимают такое свойство системы, изменение которого при обратимом процессе численно равно отношению теплоты к температуре протекания процесса:
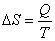 .
.Макросостояние системы
Каждое макросостояние включает в себя определенное число микросостояний. Макросостояние – свойство макрочастиц термодинамической системы, определяемое свойствами её микрочастиц, например, распределением количества микрочастиц по макрочастицам. Так, если считать макрочастицами части А и В системы, то её макросостоянием (1, 2) будет следующее распределение трёх микрочастиц: одна в части А, две в части В.
Однако суть этой функции состояния определяется статистической термодинамикой. В статистической термодинамике оперируют понятиями макро- и микросостояний системы. Число микросостояний, посредством которых реализуется данное макросостояние, связано с термодинамической вероятностью. Энтропия определяется термодинамической вероятностью: она тем выше, чем больше способов реализации макросостояния. Поэтому считается, что энтропия – мера неупорядоченности системы. Математически связь энтропии с числом макросостояний установил Людвиг Больцман в конце XIX в. и выразил её уравнением:
Микросостояние системы
Полный набор отличительных признаков всех мельчайших частей объекта определяет его микросостояние. Микросостояния – различные комбинации микрочастиц, с помощью которых можно представить одно и то же макросостояние.
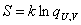 ,
,
где qU,V – термодинамическая вероятность данного состояния системы при определенном запасе внутренней энергии U и объеме V; k – постоянная Больцмана, равная 1,38·10-23 Дж/К.
Под термодинамическим состоянием системы подразумевается главным образом распределение частиц по возможным уровням энергии. В случае реальных частиц уровни колебательной энергии расположены дальше друг от друга, чем уровни вращательной энергии, а те, в свою очередь, значительно реже уровней поступательной энергии. Поэтому система, в которой частицы могут колебаться только около некоторого состояния равновесия (кристаллы), имеет гораздо меньшую энтропию, чем жидкости, так как в последнем случае возможно и вращение. Газы имеют наиболее значение энтропии, так как для частиц возможны все три вида движения.