В многоэлектронных атомах и ионах взаимодействие частиц приводит к образованию общего энергетического состояния, характеризуемого суммарным орбитальным моментом L и суммарным спином S. Геометрическую сумму (L + S) обозначают буквой J. Орбитальное квантовое число атома L обозначают символом:
| Числовое значение L | 0 | 1 | 2 | 3 | и т. д. |
| Символ | S | P | D | F | и т. д. |
Группа энергетических состояний, характеризуемая одними и теми же величинами L и S, имеет близкую энергию и образует один терм.
Мультиплетность М = (2S + 1) показывает число близких по энергии состояний, которые образуют данный терм. Термы с М = 1 называют синглетными (одиночными), термы с М = 2 – дублетными и т. д.
При записи терма сначала указывают главное квантовое число n, затем – символ суммарного орбитального момента L, левым верхним индексом которого записывают мулътиплетностъ, а правым нижним индексом – отдельные его компоненты: L+S, L+S-1, …, L-S:
Например, если S = 1, а L = 3, то символ терма имеет вид: 3F4,3,2. Это – триплет.
Волновое число любой спектральной линии, отражающей переход электрона с одного энергетического уровня на другой, может быть представлено как разность термов. Однако не любые комбинации термов возможны. Существуют правила отбора, основанные на квантово-механических представлениях, согласно которым в атоме могут осуществляться только разрешенные переходы, при которых:
— терм меняется на единицу: Δn = 0, 1, 2, 3, … (Р-S или D-Р – переходы разрешены, а Р-Р и S-D – запрещены);
— внутреннее квантовое число J не меняется (ΔJ = 0), либо меняется только на ± 1 (запрещены переходы, если ΔJ = ± 2);
— мультиплетность не меняется, ΔL = ± 1.
Эти правила отбора должны выполняться как при поглощении, так и при испускании атомом энергии.
Линии в спектре, соответствующие переходам между первым возбужденным уровнем и основным, являются наиболее интенсивными и называются резонансными.
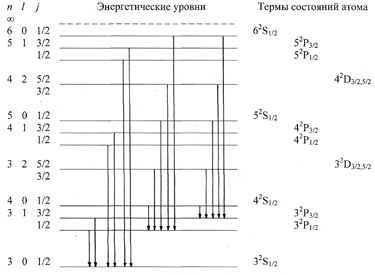
Схема энергетических уровней и разрешенные переходы (cм. рисунок 1) приведены на примере атома натрия, имеющего электронную структуру 1s22s22р63s1. Первые две оболочки (n = 1, n = 2) в атоме натрия заполнены полностью, поэтому его термы будут определяться электроном, который в основном состоянии находится на уровне 3s. Каждое энергетическое состояние этого электрона в атоме изображено на рисунке горизонтальной линией, обозначающей соответствующий энергетический уровень, и характеризуется тремя квантовыми числами – n, l, j. Верхний уровень (n = ∞), обозначенный на рис. 1 штриховой линией соответствует уровню ионизации атома. Справа от уровней приведены общепринятые обозначения состояний атома, т.е. термы. Наименьшее главное квантовое число, соответствующее основному состоянию атома, равно номеру периода, в котором находится рассматриваемый элемент. Поэтому терм Na в основном состоянии будет 32S1/2 (мультиплетность М = 2 здесь формальна, так как все S-термы являются одиночными или синглетными).
При возбуждении атома натрия электрон с уровня 3S будет переходить на уровни P, D и т. д. Термами атома в возбужденном состоянии будут 32Р3/2,1/2, 32D5/2,3/2 и т.д. Возможен и обратный самопроизвольный переход электрона. На рис. 1 показаны некоторые из разрешенных переходов. Линии, соответствующие переходам P-S, двойные, так как комбинируют двойные и одиночные термы: например, 32Р3/2-32S1/2 и 32Р1/2-32S1/2. В первом из этих переходов ΔJ = 1, а во втором ΔJ = 0. Запрет по мультиплетности не нарушается, так как формальная мультиплетность терма S в данном случае остается равной 2. Указанные переходы являются резонансными, им соответствуют линии с длиной волны 588,996 и 589,593 нм. Именно это излучение окрашивает пламя в желтый цвет при введении в него солей натрия.
 Переходы D-P более сложные (рис. 2). Термы 2D5/2 и 2D3/2 очень близки; в спектре появляются дублеты, которые соответствуют переходам 2D5/2,3/2-2Р3/2 и 2D3/2-2Р1/2. Триплет можно обнаружить только приборами высокого разрешения, так как линии 2D3/2-2Р3/2 и 2D5/2-2Р3/2 сливаются. Переход 2D5/2-2Р1/2 запрещен, так как ΔJ = 2.
Переходы D-P более сложные (рис. 2). Термы 2D5/2 и 2D3/2 очень близки; в спектре появляются дублеты, которые соответствуют переходам 2D5/2,3/2-2Р3/2 и 2D3/2-2Р1/2. Триплет можно обнаружить только приборами высокого разрешения, так как линии 2D3/2-2Р3/2 и 2D5/2-2Р3/2 сливаются. Переход 2D5/2-2Р1/2 запрещен, так как ΔJ = 2.