Исходя из упрощенного представления об атоме как о структуре сферических оболочек (модель Бора), предполагается, что отрицательно заряженные электроны связаны с положительно заряженным ядром посредством сил электростатического взаимодействия. В соответствии с положениями атомной физики электрон может занимать только определенные (дискретные) оболочки или орбиты, концентрически расположенные вокруг ядра. Внутренняя, ближайшая к ядру оболочка считается первой и т.д. В классической теории строения атома этот номер называют главным квантовым числом n. Принятое обозначение оболочек: К(n = 1), L(n = 2), M(n = 3), N(n = 4), О(n = 5) и т. д. Вид элемента, его характерные свойства определяются структурой оболочек атомов. На каждой оболочке может находиться максимальное число электронов, равное 2n2. Кроме того, каждая электронная оболочка характеризуется определенным значением энергии связи электрона с ядром – минимальной энергией, необходимой для перевода электрона в состояние, в котором на него не действует притяжение ядра. Энергия связи для определенной оболочки зависит от заряда ядра, т. е. от атомного номера Z, который также характеризует элемент. Это чрезвычайно упрощенное описание. Известно, что главные уровни расщепляются на ряд подуровней, т. е. на Li, Lii, … Mi, Mii … что, однако, не изменяет описанной выше общей картины.
Флуоресценция, или вторичное излучение атома, происходит вследствие удаления электрона с внутренней оболочки (рис. 4.1, а). Для этого требуется энергия, по меньшей мере, равная энергии связи электрона с ядром. Удаление электрона с оболочки вызывает возбуждение атома, при котором его энергия оказывается больше энергии в стабильном состоянии. Атом снова стремится перейти в стабильное энергетическое состояние. Это совершается посредством перехода электронов с более высокоэнергетических уровней на освободившееся место (вакансию). Такие электронные переходы, благодаря дискретному характеру разрешенных оболочек, предполагают вполне определенную потерю энергии атомной системы. После заполнения вакансии электроном с вышележащего уровня атом переходит в состояние с меньшей энергией. Классический закон сохранения энергии выполняется вследствие испускания электромагнитного излучения с энергией, эквивалентной разности энергетических уровней оболочек, между которыми совершается электронный переход. Испускаемый в результате перехода фотон обозначим γ. Энергия этого фотона Еγ равна ΔЕ = Еi - Еf, где Еi и Еf , соответственно, конечная и начальная энергии электрона, испытавшего переход (рис. 4.1, б). В результате многократных переходов образуется спектр характеристического излучения, содержащий набор линий, индивидуальный для каждого элемента.
Поскольку разность энергий электронных уровней ΔЕ атома индивидуальна для любого элемента, то по положению рентгеновской линии в спектре его можно идентифицировать. Положение линии в эмиссионном рентгеновском спектре легко оценить, используя закон Мозли:
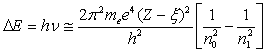 ,
, где ν – частота характеристического излучения, me – масса электрона, e – заряд электрона, h – постоянная Планка, Z – атомный номер элемента, ξ – постоянная экранирования, n0 и n1 – главные квантовые числа начального и конечного состояний.
Название характеристической линии указывает, на какую орбиталь и с какой произошел электронный переход. Так, если в результате возбуждения под действием рентгеновского излучения из атома удаляется L-электрон (то есть вакансия образуется на L-оболочке), совокупность всех возможных электронных переходов называется L-серией и обозначается Lα1, Lα2, Lα3 и т.д. Греческие буквы и числа обозначают конкретные фотоны, образующиеся за счет перехода, соответствующего конкретному характеристическому излучению. Обозначения некоторых линий приведены на рис. 5.1.
Линии излучения имеют различную интенсивность, соответствующую вероятности электронных переходов (под интенсивностью понимают число фотонов, эмитированных на единицу площади в единицу времени). Эти вероятности подчиняются классическим законам атомной физики, известным как правила отбора.
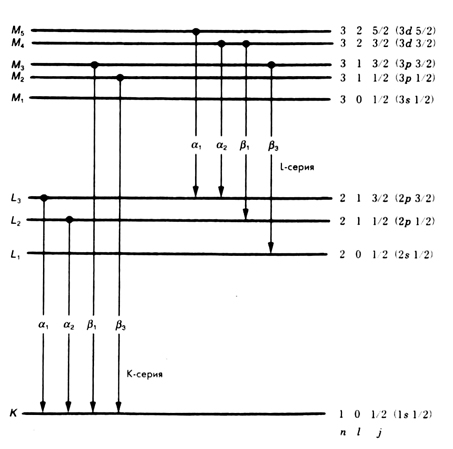
Перечислим основные особенности этих переходов.
1. Благодаря сильной связи электронов на внутренней оболочке с ядром их энергетические уровни и, следовательно, энергии переходов практически нечувствительны к химической связи атома в молекуле. В противовес этому на энергии переходов на внешних оболочках сильно влияют валентные связи, определяющие химические свойства элемента.
2. Число электронных оболочек и, следовательно, число линий излучения, эффективно проявляющихся в рентгеновских спектрах, сравнительно невелико. Следовательно, спектры характеристического рентгеновского излучения достаточно просты, что облегчает их интерпретацию и анализ.
3. Диапазон энергий характеристического рентгеновского излучения позволяет эффективно проводить анализ вещества в объеме, через который более высокоэнергетическое излучение проходит практически без поглощения.