Оксиды
1. Окисление простых веществ кислородом:
2Cu + O2 = 2CuO,S + O2 = SO2.
2. Окисление сложных веществ кислородом:
2CuS + 3O2 = 2CuO + 2SO2↑.
3. Разложение гидроксидов тяжелых металлов или кислот:
tH2SiO3 → SiO2 + H2O, t
Cu(OH)2 → CuO + H2O.
4. Разложение солей при нагревании:
t2Pb(NO3)2 → 2PbO + 4NO2↑ + O2↑.
Гидроксиды
1. Взаимодействие активных металлов или их оксидов с водой:
2K + 2H2O = 2KOH + H2↑,CaO + H2O = Ca(OH)2.
2. Труднорастворимые основания получают по реакциям обмена:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl.3. Гидроксиды щелочных и щелочноземельных металлов получают электролизом водных растворов солей:
KCl → K+ + Cl- H2O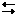 H+ + OH-
H+ + OH-(+) 2Cl- - 2e → Cl2
(-) 2H+ + 2e → H2
электролиз
2KCl + 2H2O → 2KOH + H2^ + Cl2↑.
Кислоты
1. Растворение кислотных оксидов в воде:
CO2 + H2O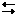 H2CO3.
H2CO3.
2. Кислоты можно получить по реакции обмена, если в результате идет процесс образования малодиссоциированного соединения:
HCl + AgNO3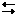 HNO3 + AgCl↓.
HNO3 + AgCl↓.
Соли
1. Взаимодействие активных металлов с кислотами:
2Na + 2CH3COOH = 2CH3COONa + H2^.2. Взаимодействие основных или амфотерных оксидов с кислотами:
MgO + 2HCl = MgCl2 + H2O,ZnO + 2HCl = ZnCl2 + H2O.
3. Взаимодействие кислот с основаниями (реакция нейтрализации):
NaOH + H2SO4 = NaHSO4 + H2O,2NaOH + H2SO4 = Na2SO4 + 2H2O.