Теория электролитической диссоциации Аррениуса пригодна лишь для водных растворов, однако при переходе к неводным растворителям она оказалась несостоятельной. Например, NH4Cl, ведущий себя как соль в водном растворе, при растворении в жидком аммиаке проявляет свойства кислоты, растворяя металлы с выделением водорода:
NH3
2NH4Cl + Ca 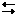 2NH3 + CaCl2 + H2.
2NH3 + CaCl2 + H2.
Мочевина CO(NH2)2, растворяясь в безводной уксусной кислоте, проявляет свойства основания, в жидком аммиаке – свойства кислоты, а ее водные растворы – нейтральны.
В связи с этим была выдвинута протолитическая теория Бренстеда и Лоури, позволившая расширить класс кислот и оснований.