На скорость химической реакции влияют следующие факторы:
Природа реагентов
Скорость химической реакции зависит от природы реагентов. Здесь большую роль играет характер химических связей в соединениях, строение их молекул. Например,
2HCl + Zn → ZnCl2 + H2↑ быстро
2CH3COOH + Zn → Zn(CH3COO)2 + H2↑ медленно
Концентрация реагентов
Чтобы произошло взаимодействие, частицы реагирующих веществ в гомогенной системе должны столкнуться. Число столкновений пропорционально числу частиц реагирующих веществ в объеме реактора, т.е. их молярным концентрациям. Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов (закон действующих масс для скорости химической реакции).
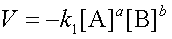 или
или 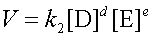 ,
,k – коэффициент пропорциональности, называемый константой скорости реакции.
Константа скорости k зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации реагирующих веществ. Константа скорости численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л.
Температура реакции
Правило Вант-Гоффа. При повышении температуры скорость большинства химических реакций существенно увеличивается, причем для реакций в гомогенных системах при нагревании на каждые 10° скорость реакции возрастает в 2–4 раза.
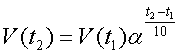 ,
,α – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции при увеличении температуры на 10°.
При повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической прогрессии. Объяснить такой эффект увеличением молекулярных столкновений нельзя, так как, согласно расчетам, при повышении температуры на 10? общее число столкновений молекул возрастает на 1,6 %, в то время как число прореагировавших молекул возрастает на 200–400 %.
Резкое увеличение скорости реакции с изменением температуры объясняет теория активации Аррениуса.
В химические взаимодействия вступают только активные частицы, обладающие энергией, достаточной для осуществления данной реакции. Доля активных столкновений, равная отношению их числа nэф. к общему числу столкновений n, изменяется с температурой.
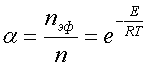 ,
,R – универсальная газовая постоянная;
Е – энергия (кДж/моль), которую нужно сообщить молекулам реагирующих веществ, чтобы превратить их в активные (энергия активации).
4) поверхность соприкосновения реагентов;
Поверхность соприкосновения реагентов
Чем больше поверхность соприкосновения реагирующих веществ, тем быстрее протекает реакция.
Присутствие катализаторов
Катализаторы – вещества, увеличивающие скорость реакции, но не входящие в состав конечных продуктов. Увеличение скорости реакции под действием катализатора называется катализом. Во многих случаях катализаторы образуют с одним из реагирующих веществ промежуточное соединение, которое реагирует с другим исходным веществом, образуя продукт и высвобождая катализатор. Иногда употребляют отрицательные катализаторы – ингибиторы, которые замедляют нежелательные химические реакции.
