Предсказание типа гибридизации проводится на основании донорно-акцепторного механизма образования связи. Например, проведем оценку геометрической формы водородных соединений элементов II периода.
1. Оценим степени окисления элементов:
Be+2H2-1
2. Запишем сокращенные электронные конфигурации атомов и условных ионов:
Be 1s22s22p0 Be+2 2s02p0
H 1s1 H-1 1s2
3. Для того, чтобы атом бериллия образовал две связи, необходимо, чтобы он имел два неспаренных электрона. Это происходит при переходе атома в возбужденное состояние, электронная конфигурация будет
Be* 1s22s12p1
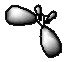
4. Связи Be–H в молекуле BeH2 равнозначны, поэтому предполагается, что у атома бериллия одна 2s- и одна 2p-орбитали гибридизуются в две sp-орбитали, которые расходятся в пространстве на максимально возможное расстояние (180°).

5. Гибридизованные орбитали перекрываются с 1s-орбиталями двух атомов водорода, в результате чего образуется линейная молекула BeH2.

1. B+3H3-1
2. B+3 (2s02p0) и H-1 (2s2)
3. У атома бора одна 2s- и две 2p-орбитали гибридизуются в три sp2-гибридные орбитали, которые расходятся в пространстве на угол 120°. Форма молекулы – треугольная.
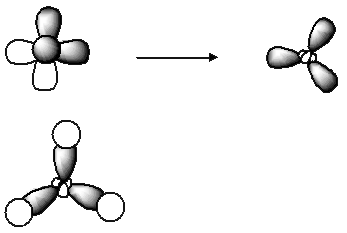
1. C-4H+1
2. C-4 (2s22p2) H+1 (1s0)
3. У атома кремния одна 3s- и три 3p-орбитали гибридизуются в четыре sp3-гибридные орбитали, которые расходятся в пространстве на угол 109°28'. Форма молекулы – тетраэдрическая.
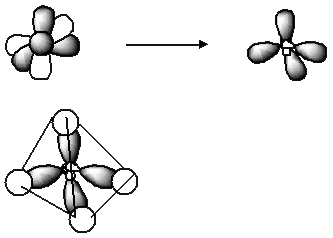
Если у атомов A молекулы ABn имеется неподеленная пара электронов, то ее надо учитывать при определении типа гибридизации. В качестве примеров можно привести тетраэдрические молекулы NH3 и H2O. Неподеленные электронные пары, несущие на себе частично отрицательный заряд, отталкивают электронные облака образовавшихся связей, в результате чего молекула перестает быть плоской. Такие тетраэдры называются химически незавершенными (в некоторых вершинах нет атомов водорода); кроме того, электростатическое отталкивание атомов H+1 от неподеленной пары азота или двух пар кислорода несколько искажает тетраэдр и уменьшает углы между связями от значения 109°28':
H–N–H 107°

H–O–H 105°