Карбоновые кислоты – органические соединения, молекулы которых содержат карбоксильную группу
 .
.
Общая формула гомологического ряда одноосновных насыщенных карбоновых кислот CnH2n+1COOH.
По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые (одноосновные кислоты) и ди-, три- и т.д. карбоновые (многоосновные кислоты). Например:
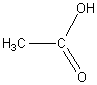
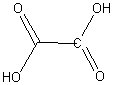 .
.
уксусная кислота щавелевая кислота
Ароматические карбоновые кислоты
Непредельные карбоновые кислоты
Многоосновные карбоновые кислоты
Строение
Карбоксильная группа состоит из карбонильной группы и гидроксильной группы, которые оказывают взаимное влияние друг на друга:
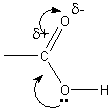
Неподеленная электронная пара кислорода в гидроксильной группе смещена в сторону карбонильного углерода (+М – положительный мезомерный эффект). Это ослабляет связь O–H, в результате чего кислотные свойства увеличиваются. Смещение неподеленной электронной пары от кислорода к углероду частично компенсирует положительный заряд, в результате активность карбонильной группы ослабляется.
Номенклатура
Названия карбоновых кислот производят от названия соответствующего углеводорода с добавлением окончания «-овая кислота». Нумерацию атомов углерода начинают с углерода карбоксильной группы, например:
CH3–CH2–COOH CH3–CH2–CH–COOH
|
пропановая кислота CH3
2-метилбутановая
кислота
Для первых членов гомологического ряда обычно употребляют тривиальные названия:
HCOOH – муравьиная кислота,
CH3COOH – уксусная кислота,
C2H5COOH – пропионовая кислота,
C3H7COOH – масляная кислота,
C4H9COOH – валериановая кислота.
Изомерия
1) Начиная с четвертого члена ряда – бутановой кислоты – возможна изомерия углеводородного скелета, например:
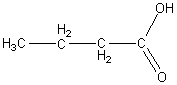
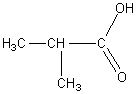
бутановая кислота изобутановая
или
2-метилпропановая кислота
2) Межклассовая изомерия со сложными эфирами, например:
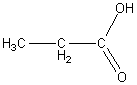
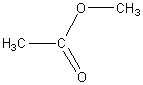
пропановая кислота метиловый эфир уксусной кислоты
Получение
1) Окисление альдегидов:

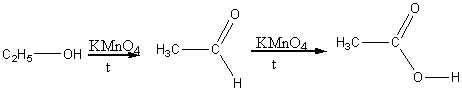
2) Окисление первичных спиртов:

3) Окисление алканов
t, кат.
C4H10 + 2O2 ------> 2CH3COOH.
 |
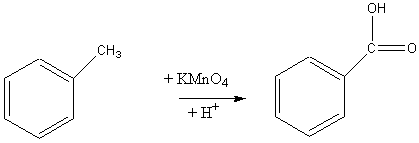
4) Окисление гомологов бензола:
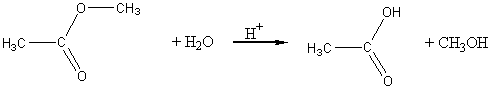
5) Гидролиз сложных эфиров:
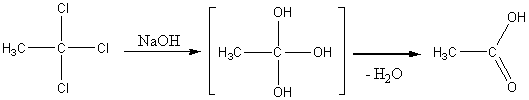
6) Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода:
Химические свойства
1) Кислотные свойства:
а) реагируют с активными металлами с выделением водорода:
2R–COOH + Mg → (R–COO)2Mg + H2,
б) реагируют с основными оксидами:
2R–COOH + CaO → (R–COO)2Ca + H2O,
в) реагируют с основаниями (реакция нейтролизации):
R–COOH + NaOH → R–COONa + H2O,
г) реагируют с солями слабых кислот:
R–COOH + NaHCO3 → R–COONa + H2O + CO2,
д) соли карбоновых кислот в водных растворах подвергаются гидролизу:
CH3COO- + H2O → CH3COOH + OH-.
2) Образование сложных эфиров:
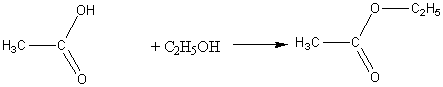
этилацетат
3) Под действием водоотнимающих средств (например, P2O5) отщепляют воду, образуя ангидриды:
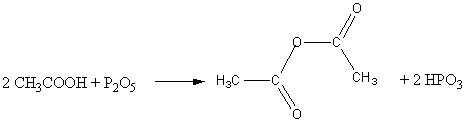
уксусный ангидрид
4) Реакция с галогенами:
Pкр
CH3–CH2–COOH + Cl2 → CH3–CHCl–COOH + HCl.
5) Замещение ОН-группы с образованием галогенангидридов:

6) Образование амидов:
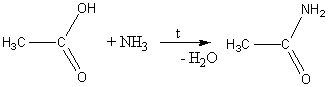
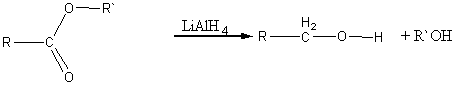
7) Восстановление до первичных спиртов:
LiAlH4
R–COOH → R–CH2–OH + H2O.
Так как у муравьиной кислоты гидроксильная и карбонильная группы находятся у единственного атома углерода, то свойства данной кислоты несколько отличаются от свойств всего класса карбоновых кислот.
Особые свойства муравьиной кислоты:
а) дегидратация
H2SO4
HCOOH → CO + H2O,
б) реакция «серебряного зеркала» (как у альдегидов):
HCOOH + 2[Ag(NH3)2OH] → 2Ag + (NH4)2CO3 + 2NH3 +H2O,
в) взаимодействие с галогенами:
HCOOH + Cl2 → CO2 + 2HCl.
Ароматические карбоновые кислоты
Простейшим представителем ароматических карбоновых кислот является бензойная кислота C6H5COOH:
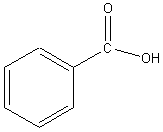
Получение
1) Окисление толуола кислородом воздуха:
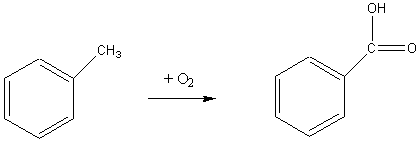
2) Гидролиз бензотрихлорида:
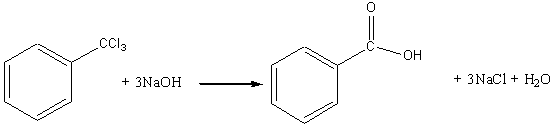
Химические свойства
1) Свойства, типичные для карбоновых кислот.
2) Реакции замещения в ядро:
а) галогенирование:

б) нитрование:
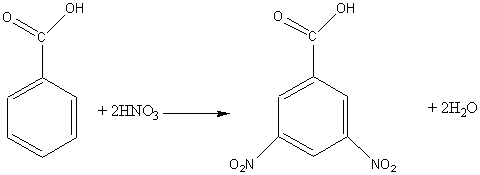
Непредельные карбоновые кислоты
К непредельным карбоновым кислотам относятся органические соединения, содержащие карбоксильную группу, соединенную с непредельным углеводородным радикалом (алкеном). Общая формула гомологического ряда – CnH2n-1COOH. Первым представителем класса является акриловая (пропеновая) кислота:
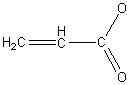
Получение
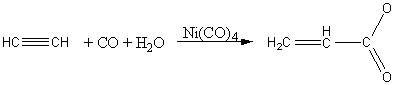
Химические свойства
1) Свойства, типичные для кислот.
2) Свойства, типичные для алкенов (реакции присоединения). Присоединение несимметричных молекул идет против правила Марковникова за счет сопряжения двойных связей
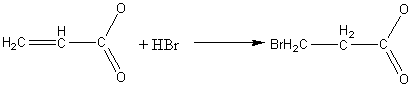
3-бромпропановая
кислота
Многоосновные карбоновые кислоты
Простейшей дикарбоновой кислотой является щавелевая кислота:

Получение
t
2HCOONa → NaOOC–COONa + H2,
NaOOC–COONa + 2HCl → HOOC–COOH + 2NaCl.
Химические свойства
1) Свойства, типичные для кислот.
2) В отличие от однокарбоновых кислот многоосновные кислоты могут образовывать кислые (гидро-, дигидро- и т.д.) и средние соли.
HOOC–COOH + NaOH → NaOOC–COOH + H2O
гидрооксалат натрия
HOOC–COOH + 2NaOH → NaOOC–COONa + H2O
оксалат натрия
3) Разложение при нагревании:
200 °C
а) HOOC–COOH → HCOOH + CO2,
t
б) HOOC–COOH → CO2 + CO + H2O.
H2SO4
Сложные эфиры
Сложные эфиры – производные карбоновых кислот, у которых атом водорода в карбоксильной группе замещен на углеводородный радикал. Общая формула сложных эфиров:
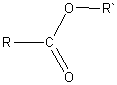
Получение
1) Взаимодействие спиртов и кислот (реакция этерификации):
а) с неорганическими кислотами:
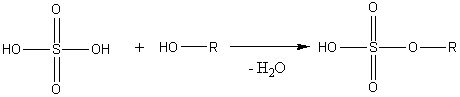
б) с карбоновыми кислотами:
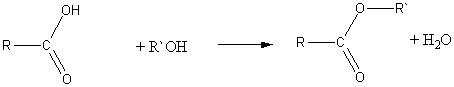
2) Взаимодействие хлорангидридов кислот с алкоголятами щелочных металлов:
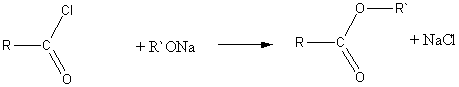
Химические свойства
1) Гидролиз:

2) Восстановление: