Газы являются наиболее простым объектом для исследования, поэтому их свойства, а также реакции между газообразными веществами изучены наиболее хорошо. Все свойства газов, их превращения подчиняются следующим законам: закон Авогадро, закон Бойля-Мариотта, закон Гей-Люссака, объединенный газовый закон, уравнение Менделеева-Клапейрона.
Закон Авогадро
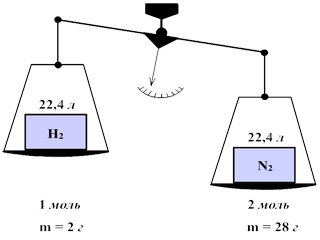
В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
При нормальных условиях (Т = 273 К (0 °С) и давлении 101325 Па (1 атм.)) один моль занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа.
Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
PV = const.
Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const.
Закон Шарля
При постоянном объеме давление газа обратно пропорционально температуре:
P/T = const.
Объединенный газовый закон
Для любого газа отношение произведения давления и объема к температуре есть величина постоянная:
PV/T = const.
Уравнение Менделеева-Клапейрона
PV = nR,
или
PV = RTm/M,
где R = 8,314 Дж/(моль·К) – универсальная газовая постоянная,
М – молярная масса газа, г/моль,
n – количество вещества газа, моль,
m – масса, г.