К элементам VIA-подгруппы относятся кислород, сера, селен, теллур, полоний.

Кислород
Первооткрыватель Дж. Пристли и К. Шееле (1774 г.).
Положение в периодической системе
период II,
группа VIA.
Электронная конфигурация (в основном состоянии) 1s22s22p4.
Изотопы 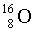 99,76 %,
99,76 %,
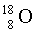 0,20 %.
0,20 %.
Степени окисления -2 (1s22s22p6),
-1 (1s22s22p5) H2O2, M2O2,
0 (1s22s22p4) O2, О3,
+2 (1s22s22p2) OF2.
Энергия ионизации 1313,9 кДж/моль.
Сродство к электрону 141 кДж/моль.
Простое вещество – кислород O2 – в обычном состоянии газ, без запаха, немного тяжелее воздуха. Кислород – самый распространенный элемент на Земле. При комнатной температуре относительно нереакционноспособен; при высоких температурах связь между атомами ослабляется, в результате чего активность кислорода возрастает. Кислород является сильным окислителем, который реагирует со многими простыми и сложными веществами. Аллотропная форма кислорода – озон О3 – более сильный окислитель, чем молекулярный двухатомный кислород.
tпл 54,8 K.
tкип 90,188 К.
Получение:
1. Промышленный способ – перегонка жидкого воздуха.
2. В лабораторных условиях – термическое разложение кислородсодержащих солей:
2KMnO4 = K2MnO4 + MnO2 + O2↑,
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 + 3O2↑,
2KClO3 = 2KCl + 3O2↑,
2H2O2 = 2H2O + O2↑.
Применение: металлургические процессы, медицина, сварка, как окислитель ракетных топлив.

Сера
Первооткрыватель Х. Бранд.
Положение в периодической системе
период III,
группа VIA.
Электронная конфигурация (в основном состоянии) 1s22s22p63s23p4.
Изотопы 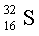 95 %,
95 %,
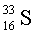 0,75 %,
0,75 %,
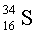 4,21 %.
4,21 %.
Степени окисления -2 (1s22s22p63s23p6),
-1 (1s22s22p63s23p5),
0 (1s22s22p63s23p4) S6, S8,
+2 (1s22s22p63s23p2),
+3 (1s22s22p63s23p1),
+4 (1s22s22p63s2),
+5 (1s22s22p63s1),
+6 (1s22s22p6).
Энергия ионизации 999,6 кДж/моль.
Сродство к электрону 200,4 кДж/моль.
Простое вещество – сера. Существует в нескольких аллотропных модификациях (ромбическая, моноклинная, пластическая), из которых наиболее устойчива S8 – ромбическая. Сера – твердое кристаллическое вещество желтого цвета, устойчива к воздействию воздуха, нерастворима в воде, при нагревании горит.
tпл 386,0 K.
tкип 717,8 К.
Получение:
1. Сера встречается в природе в свободном виде.
2. Неполное окисление сероводорода:
2H2S + O2 = 2S + 2H2O,
H2S + Br2 = S + 2HBr.
3. Восстановление SO2, SO3 или H2SO4:
2SO3 + 3C = 2S + 3CO2.
Применение: химическая промышленность, вулканизация каучука, в медицине используется как средство для лечения кожных заболеваний, защита растений от мучнистой росы.
Атомы данных элементов на внешнем электронном слое имеют 6 электронов. Конфигурация внешнего слоя ns2np4, что обуславливает окислительные свойства данных элементов. Окислительная способность уменьшается с увеличением заряда ядра атомов. Кислород и сера являются типичными неметаллами, селен и теллур проявляют промежуточные свойства между металлами и неметаллами (металлоиды), полоний – типичный металл. Кислород является очень сильным окислителем (занимает второе место после фтора), поэтому практически во всех соединениях с другими элементами его степень окисления равна -2 (исключение фторид кислорода (+2) и перекисные соединения (-1)). Другие элементы могут проявлять степень окисления -2, +4, +6.
Энергетические характеристики атома и физические свойства простых веществ
Энергетические характеристики атомов и физические свойства простых веществ
| O | S | Se | Te | ||
| Порядковый номер | 8 | 16 | 34 | 52 | 84 |
| Относительная атомная масса | 15,999 | 32,067 | 78,98 | 127,60 | 208,982 |
| tпл., °С | -219 | 119 | 217 | 450 | 254 |
| tкип., °С | -183 | 445 | 685 | 1390 | 962 |
| Плотность, г/см3 | 1,27 | 2,1 | 4,8 | 6,2 | 9,4 |
Химические свойства
Кислород
Кислород является сильным окислителем:
а) взаимодействие с металлами:
2Mg + O2 = 2MgO, 2Fe + 3O2 = 2Fe2O3,б) взаимодействие с неметаллами происходит при нагревании:
С + O2 = CO2, N2 + O2 = 2NO,в) взаимодействие со сложными веществами:
2H2S + 3O2 = 2SO2 + 2H2O, 4NH3 + 3O2 = 2N2 + 6H2O.Сера
1. С более электроположительными веществами сера проявляет окислительные свойства:
Hg + S = HgS, 2Fe + 3S = Fe2S3.2. С более электроотрицательными веществами сера – восстановитель:
S + O2 = SO2↑, S + Cl2 = SCl2, S + 6HNO3(конц) = H2SO4 + 6NO2↑ + 2H2O.3. Для серы характерны реакции диспропорционирования:
S + H2SO4(конц) = SO2↑ + 2H2O.Качественные реакции на ионы
SO42-
1) Взаимодействие сульфат ионов с солями бария в азотной кислоте.
Гидрид серы H2S - сероводород
Сероводород – бесцветный газ с запахом тухлых яиц, ядовит.
Получение1. Взаимодействие сульфидов с кислотами:
FeS + 2HCl = H2S↑ + FeCl2.2. Взаимодействие серы с газообразным водородом
S + H2 = H2S↑. Химические свойства1. Сероводород – сильный восстановитель, в зависимости от условий сульфид-ион окисляется до S, SO42-, SO2:
H2S + Br2 = S + 2HBr, H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl, H2S + H2SO4(конц) = S + SO2↑ + 2H2O.2. Водный раствор сероводорода – слабая двухосновная кислота, диссоциирующая ступенчато:
H2S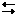 H+ + HS- K1= 1,0·10-7,
HS-
H+ + HS- K1= 1,0·10-7,
HS- 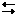 H+ + S2-
H+ + S2- Оксиды серы
Для серы характерны два оксида SO2 и SO3 с кислотными свойствами.
Получение SO2: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 H2S + H2SO4(конц) = S + SO2 + 2H2O SO3: 2SO2 + O2 = 2SO3 tFe2(SO4)3 → Fe2O3 + 3SO3
Химические свойства
1. Взаимодействие с водой:
а) SO2 + H2O = H2SO3, б) SO3 + H2O = H2SO4.2. Взаимодействие с основанием:
а) SO2 + NaOH = NaHSO3, NaHSO3 + NaOH = Na2SO3 + H2O, б) SO3 + NaOH = NaHSO4, NaHSO4 + NaOH = Na2SO4 + H2O.3. Реакции восстановления:
а) SO2 + 2H2S = 3S + 2H2O, б) 2SO3 + 3C = 2S + 3CO2↑.4) Реакции окисления:
SO2 + NO2 + H2O = H2SO4 + NO↑.Кислоты
Сернистая кислота – кислота слабая, малоустойчивая, образуется при растворении SO2 в воде:
SO2 + H2O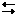 H2SO3.
H2SO3.
Являясь слабой кислотой, сернистая кислота диссоциирует ступенчато:
H2SO3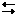 HSO3- + H+ K1=1,6·10-2,
HSO3-
HSO3- + H+ K1=1,6·10-2,
HSO3- 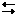 SO32- + H+
SO32- + H+ Соли сернистой кислоты называются сульфитами. Они, как правило (кроме солей щелочных металлов), плохо растворимы в воде.
Серная кислота – бесцветная, тяжелая, маслянистая жидкость, растворяется в воде в неограниченных количествах. Серная кислота – один из ключевых продуктов химической промышленности.
Промышленный способ получения H2SO4 осуществляется в три этапа:
1. Синтез SO2:
1400°C2CaSO4 + C(кокс) → 2CaO + 2SO2↑ + CO2↑.
2. Окисление сернистого газа:
2SO2 + O2 = 2SO3.3. Растворение оксида серы (VI) в воде или разбавленной серной кислоте:
SO3 + H2O = H2SO4.Раствор серной кислоты, насыщенный оксидом серы (VI), называется олеумом. Помимо серной кислоты и SO3 в олеуме содержится продукт их взаимодействия – дисерная кислота:
SO3 + H2SO4(безводная)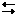 H2S2O7.
H2S2O7.
Химические свойства H2SO4
Концентрированная серная кислота – сильный окислитель. При химической реакции в зависимости от силы восстановителя в качестве продуктов восстановления серной кислоты могут образовываться SO2, S, H2S.
H2SO4(конц) + 2Ag = SO2↑ + Ag2SO4 + 2H2O, H2SO4(конц) + H2S = SO2↑ + S + 2H2O, 5H2SO4(конц) + 4Zn = H2S + 4ZnSO4 + 4H2O.Из металлов с серной кислотой не реагируют Pt и Au, а Bi, Co, Fe, Mg – пассивируются.
Серная кислота является сильной и диссоциирует по первой ступени полностью. Сила кислоты при диссоциации по второй ступени ослабевает:
H2SO4 → H+ + HSO4-, HSO4-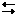 H+ + SO42-
H+ + SO42-