К IA-подгруппе относятся литий, натрий, калий, рубидий, цезий, франций.

Литий
Первооткрыватель А. Арфедсон (1817 г.).
Положение в периодической системе:
период II,
группа IA.
Электронная конфигурация (в основном состоянии) 1s22s1.
Изотопы 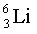 ,
,
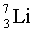 .
.
Степени окисления +1 (1s2) практически во всех соединениях,
-1 (1s22s2) в жидком аммиаке
Энергия ионизации 513,3 кДж/моль.
Сродство к электрону 59,6 кДж/моль.
Простое вещество – литий – металл.
tпл 453,69 K.
tкип 1620 К.
Применение: компонент подшипниковых сплавов, сырье для получения металлорганических катализаторов, компонент химических источников тока.

Натрий
Первооткрыватель Г. Дэви (1807 г.).
Положение в периодической системе:
период III,
группа IA.
Электронная конфигурация (в основном состоянии) 1s22s22p63s1.
Изотопы 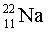 ,
,
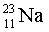 – 100 %,
– 100 %,
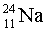
Степени окисления +1 (1s2s22p6) практически во всех соединениях,
-1 (1s22s22p63s2) в жидком аммиаке.
Энергия ионизации 495,8 кДж/моль.
Сродство к электрону 52,9 кДж/моль.
Простое вещество – натрий – металл.
tпл 370,96 K.
tкип 1156 К.
Применение: наполнитель натриевых газоразрядных ламп, жидкий теплоноситель в ядерных реакторах, осушитель органических реактивов, органический и неорганический синтез.
Калий
Первооткрыватель Г. Дэви (1807 г.).
Положение в периодической системе:
период IV,
группа IA.
Электронная конфигурация (в основном состоянии) 1s22s22p63s23p64s1.
Изотопы 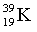 – 93,2 %,
– 93,2 %,
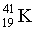 – 6,7 %,
– 6,7 %,
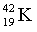 .
.
Степени окисления +1 ( 1s22s22p63s23p6 ) практически во всех соединениях,
-1 ( 1s22s22p63s23p64s2) в жидком аммиаке.
Энергия ионизации 418,8 кДж/моль.
Сродство к электрону 48,4 кДж/моль.
Простое вещество – калий – металл.
tпл 336,8 K.
tкип 1047 К.
Применение: электролит в никель-кадмиевом аккумуляторе, производство минеральных удобрений, органический и неорганический синтез.

Рубидий
Первооткрыватель Р. Бунзен, Кирхгоф (1861 г.).
Положение в периодической системе:
период V,
группа IA.
Электронная конфигурация (в основном состоянии) 1s22s22p63s23p63d104s24p65s1.
Изотопы 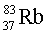 ,
,
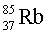 – 83 %,
– 83 %,
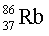 ,
,
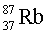 – 27 %.
– 27 %.
Степени окисления +1 (1s22s22p63s23p63d104s24p6) практически во всех соединениях,
-1 (1s22s22p63s23p63d104s24p65s2) в жидком аммиаке.
Энергия ионизации 403 кДж/моль.
Сродство к электрону 46,9 кДж/моль.
Простое вещество – рубидий – металл.
tпл 312,2 K.
tкип 961 К.
Применение: научно-исследовательские работы.
На внешнем электронном слое у атомов данных элементов содержится один электрон на s-подуровне.
Конфигурация внешней электронной оболочки – ns1. Для завершения внешней электронной оболочки атомам щелочных металлов выгодно отдавать один электрон. Поэтому степень окисления щелочных металлов во всех соединениях +1.
С увеличением заряда ядра увеличивается радиус атомов, что влияет на изменение химических свойств: металлические свойства увеличиваются в ряду элементов Li < Na < K < Rb < Cs < Fr, так как сила притяжения внешнего электрона к ядру уменьшается.
Энергетические характеристики атома и физические свойства простых веществ
Получение
1. Электролиз расплава хлоридов или гидроксидов:
(-) K+ + 1e → K(+) 2Cl- - 2e → Cl2
--------------------------
2KCl → 2K + Cl2.
(-) K+ + 1e → K
(+) 4OH- - 4e → O2 + 2H2O
--------------------------------------
4KOH → 4K + 2H2O + O2.
2. Электролиз растворов солей в пиридине (неводные растворители).
Энергетические характеристики атомов и физические свойства простых веществ
| Li | Na | K | Rb | Cs | |
| Порядковый номер | 3 | 11 | 19 | 37 | 55 |
| Относительная атомная масса | 6,941 | 22,990 | 39,098 | 85,486 | 132,905 |
| tпл., °С | 179,0 | 97,8 | 63,5 | 39,0 | 28,5 |
| tкип., °С | 1340 | 883 | 760 | 696 | 708 |
| Плотность, г/см3 | 0,534 | 0,97 | 0,86 | 1,532 | 1,87 |
Типичные металлы с характерным металлическим блеском, легкие, хорошо режутся ножом (за исключением лития). На воздухе очень быстро теряют свой блеск; рубидий и цезий на воздухе самовоспламеняются.
Химические свойства
1. Взаимодействие с водой:
2K + 2H2O = 2KOH + H2.
2. Взаимодействие с кислотами:
2Na + 2HCl = 2NaOH + H2.
3. Взаимодействие с неметаллами:
2Na + H2 = 2NaH (гидрид натрия),2Na + Cl2 = 2NaCl (хлорид натрия),
2K + 2C = 2K2C2 (карбид калия),
6Na + N2 = 2Na3N (нитрид натрия).
4. Взаимодействие с кислородом:
4Li + O2 = 2Li2O (оксид лития),2Na + O2 = Na2O2 (пероксид натрия),
K + O2 = KO2 (надпероксид калия).
5. Взаимодействие со спиртами:
2Na + 2C2H5OH = 2C2H5ONa + H2.
Соединения
Общая формула оксидов щелочных металлов R2O. Все оксиды щелочных металлов проявляют основные свойства.
1. Взаимодействие с водой:
Na2O + H2O = 2NaOH.
2. Взаимодействие с кислотными оксидами:
K2O + CO2 = K2CO3.
3. Взаимодействие с кислотами:
Li2O + 2HCl = 2LiCl + H2O.
Общая формула гидроксидов ROH. Гидроксиды щелочных металлов – сильные основания (щелочи).
1. Взаимодействие с кислотными оксидами:
2NaOH + CO2 = Na2CO3 + H2O.
2. Взаимодействие с кислотами:
2KOH + H2SO4 = K2SO4 + 2H2O.
