2.1. Водород
В периодической системе Д.И. Менделеева водород занимает первое место. Он имеет сравнительно простое строение атома: ядро, содержащее один протон, окруженное электронным облаком. Электронная конфигурация атома 1s1.
Для завершения своего внешнего электронного облака атом водорода может либо отдавать один электрон, либо принимать его, в результате этого он проявляет свойства, характерные для металлов и для неметаллов. Именно поэтому водород в периодической системе помещают и в I группу, и в VII.
Водород
Первооткрыватель – Г. Кавендиш (1766 г.).
Положение в периодической системе – 1 период.
Электронная конфигурация (в основном состоянии) – 1s2.
Степени окисления: +1 (1s0)
0 1s1
-1 (1s2)
Энергия ионизации – 1312 кДж/моль.
Сродство к электрону – 72,8 кДж/моль.
Изотопы 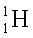 – пропий
– пропий
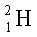 (
(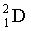 ) – дейтерий
) – дейтерий
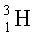 (
(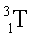 ) – тритий
) – тритий
В свободном виде водород образует одно простое вещество Н2, в молекуле которого два атома водорода соединены ковалентной σ-связью.
Ткип. = 20,28 К.
Тпл. = 14,01 К.
Получение
1. Взаимодействие металлов, стоящих в ряду напряжения перед водородом, с кислотами:
Zn + 2HCl → ZnCl2 + H2.
2. Взаимодействие амфотерных металлов, например алюминия, с водными растворами щелочей:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2.
3. Восстановление воды щелочными или щелочноземельными металлами:
2K + 2H2O → 2KOH + H2.
4. Электролиз водных растворов щелочей, кислот, солей:
Na2SO4
2H2O  2H2 + O2,
2H2 + O2,
электролиз
2NaCl + 2H2O  H2 + Cl2 + 2NaOH.
H2 + Cl2 + 2NaOH.
электролиз
5. Восстановление водяного пара металлами (Mg, Zn, Fe и др.):
t3Fe + 4H2O
 Fe3O4 + 4H2.
Fe3O4 + 4H2.
6. Конверсия метана:
CH4 + H2O → CO2 + 3H2,
CO + H2O → CO2 + H2.
Химические свойства
1. Горение:
2H2 + O2 → 2H2O + 484 кДж.
2. Реакции с неметаллами:
H2 + Cl2 → 2HCl,
t
H2 + S → H2S,
t, P
3H2 + N2 → 2NH3.
3. Реакция образования гидридов со щелочными и щелочноземельными металлами:
H2 + 2K → 2KH.
4. Восстановление оксидов металлов:
WO3 + 3H2 → W + 3H2O.
5. Гидрирование непредельных органических соединений:
Ni, tCH3–CH =CH2 + H2 → CH3–CH2–CH3
Применение
1. Органический и неорганический синтез.
2. Получение высоких температур (горение).
3. Резка металлов.
4. Переработка нефти (реакции гидрирования).
Вода (H2O)
Одним из наиболее распространенных веществ в природе является вода. Вода играет главенствующую роль в жизнедеятельности живых организмов, высока ее роль в промышленном производстве и быту. Являясь слабым электролитом, вода диссоциирует на ион водорода и гидроксид-ион:
H2O H+ + OH- K=1,8·10-16.
Так как ион водорода – частица очень маленькая, в водных растворах существует только в виде иона гидроксония:
H+ + H2O
H+ + OH- K=1,8·10-16.
Так как ион водорода – частица очень маленькая, в водных растворах существует только в виде иона гидроксония:
H+ + H2O  H3O+.
Вода является амфотерным соединением и в протолитических равновесиях способна принимать или отдавать протон, выступая соответственно в роли основания или кислоты.
H3O+.
Вода является амфотерным соединением и в протолитических равновесиях способна принимать или отдавать протон, выступая соответственно в роли основания или кислоты.
Физические свойства
Вода – единственное химическое соединение, которое в природных условиях существует в виде трех агрегатных состояний: твердое вещество (лед), жидкое (вода), газообразное (водяной пар).
Ткип. = 373 К (100 °С) Тпл. = 273 К (0°С) В жидком состоянии – вещество без цвета, без запаха, без вкуса. Тип связи – ковалентная полярная. Гибридизация – sp3. Угол между связями H–O – 109°.Химические свойства
1. Реакции кислотно-основного взаимодействия:
а) взаимодействие с кислотными оксидами H2O + CO2 H2CO3,
б) взаимодействие с основными оксидами
Na2O + H2O
H2CO3,
б) взаимодействие с основными оксидами
Na2O + H2O 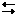 2NaOH,
в) гидролиз солей
Na2CO3 + H2O
2NaOH,
в) гидролиз солей
Na2CO3 + H2O 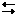 NaHCO3 + NaOH,
MnCl2 + H2O
NaHCO3 + NaOH,
MnCl2 + H2O 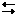 MnOHCl + HCl.
MnOHCl + HCl.
2. Образование кристаллогидратов:
CuSO4 + 5H2O = CuSO4·5H2O.3. Окислительные свойства воды (взаимодействие с металлами, стоящими в ряду напряжений до водорода):
Ca + 2H2O = Ca(OH)2 + H2↑. 3Fe + 4H2O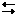 Fe3O4 + 4H2↑.
Fe3O4 + 4H2↑.
Пероксид водорода (H2O2)
Физические свойства
Бесцветная (слегка голубоватая) сиропообразная жидкость, без запаха.
Tпл.= -0,48 °C. Плотность – 1,45 г/см3.Химические свойства
1. Реакция разложения:
2H2O2 = 2H2O + O2↑ + 197,5 кДж.2. Окислительные свойства:
2KI + H2O2 = I2 + 2KOH, PbS + 4H2O2 = PbSO4 + 4H2O.3. Восстановительные свойства:
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2↑ + 8H2O, Ag2O + H2O2 = 2Ag + H2O + O2↑.4. Образование пероксидов металлов:
Ba(OH)2 + H2O2 = BaO2 + 2H2O.