Распределение электронной плотности по атомам пиридинового кольца показано на схеме:
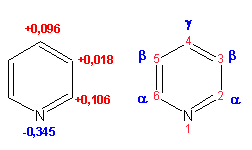
Молекула пиридина поляризована, и отрицательный центр поляризации сосредоточен на атоме азота. Вследствие этого, как уже было отмечено ранее, электрофильное замещение в пиридине протекает значительно труднее, чем в незамещенном бензоле, а нуклеофильное – легче, особенно при взаимодействии с сильными основаниями:
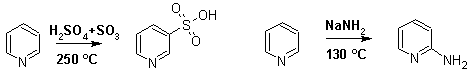
Так, сульфирование пиридина пиросерной кислотой протекает при 250 °С в бета-положении, нитрование нитратом калия в азотной кислоте также проходит с трудом, только при 350 °С и с выходом 15 %, в то время как реакция с амидом натрия идет при сравнительно небольшом нагревании.
Атом азота в пиридине устойчив по отношению к окислителям, поэтому алкилпиридины легко окисляются до пиридинкарбоновых кислот:

Однако, под действием перекисей, пиридин легко превращается в окись пиридина:
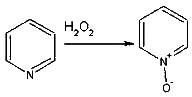
Последняя легко подвергается реакциям электрофильного замещения, с образованием замещенных, подобно активированным электронодонорными заместителями производным бензола:
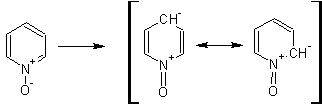
На схеме отчетливо видно, каким образом в окиси пиридина кольцо активировано к электрофильному замещению, притом, во 2-м и 4-м положениях.
Это важный способ получения производных пиридина, которые не могут быть получены путем прямого замещения. После реакции замещения окись восстанавливают в пиридин диметилсульфоксидом.