Последовательность чередования аминокислотных остатков в полипептидной цепи называется первичной структурой белка (или первым уровнем структурной организации белковой молекулы).
Первичная структура белка
Перечень остатков аминокислот, начиная от края молекулы со свободной аминогруппой, например: NH2-Арг-Лиз-Лей-Про-Вал-Три-СООН.
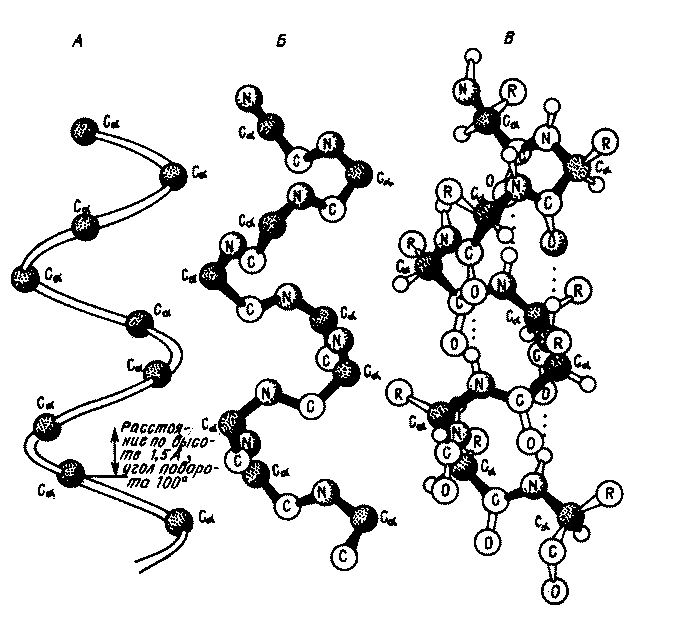
Закручивание полипептидной цепи белка в спиралеобразную структуру (α-спираль) происходит вследствие взаимодействия посредством образования водородных связей между кислородом карбонильной группы i-го аминокислотного остатка и водородом амидогруппы i+4 аминокислотного остатка:
α-спираль
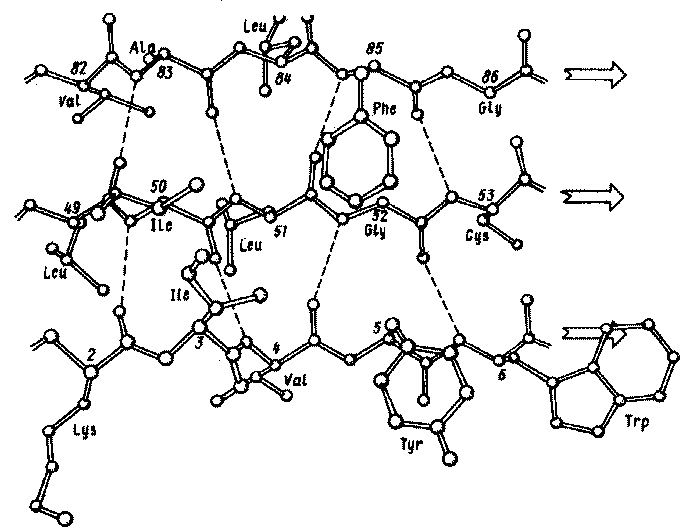
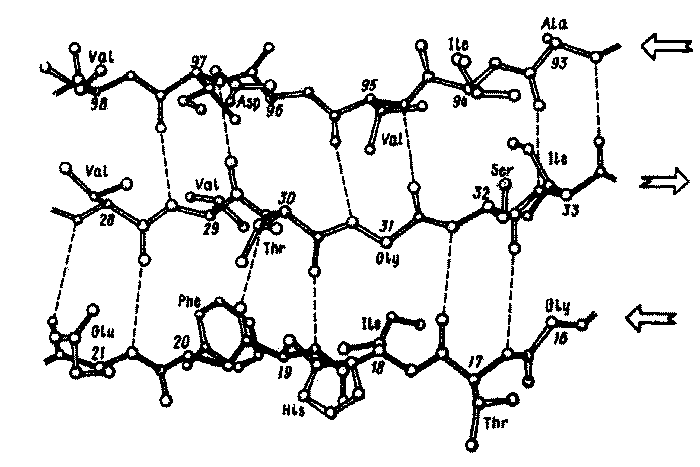
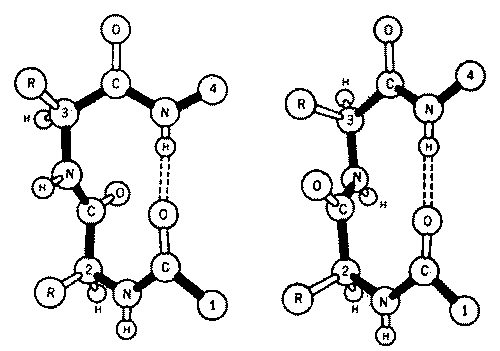
Наряду со спирализованными участками в образовании вторичной структуры белка принимают также участие β-структуры параллельная и антипараллельная, и β-изгиб.
β-структуры параллельная
Антипараллельная
β-изгиб
При упаковке вторичной структуры белка в пространстве образуется третичная структура белка, состоящая из всех компонентов вторичной структуры. При образовании третичной структуры белка происходят гидрофобные, ионные (электростатические), водородные ковалентные взаимодействия между группировками в боковых радикалах аминокислотных остатков полипептидной цепи.
Третичная структура белка

С появлением третичной структуры у белка появляются и новые свойства – биологические. В частности, проявление каталитических свойств связано именно с наличием у белка третичной структуры. И наоборот, нагревание белков, приводящее к разрушению третичной структуры (иначе известно как денатурация) одновременно приводит к утрате биологических свойств.
Четвертичная структура белка подразумевает такое объединение белков третичной структуры, при котором появляются новые биологические свойства, не характерные для белка в третичной структуре. Каждый из белков – участников третичной структуры – при образовании четвертичной структуры называют субъединицей или протомером. В образовании четвертичной структуры белка принимают участие те же связи, что и при образовании третичной структуры, за исключением ковалентных.
Четвертичная структура белка
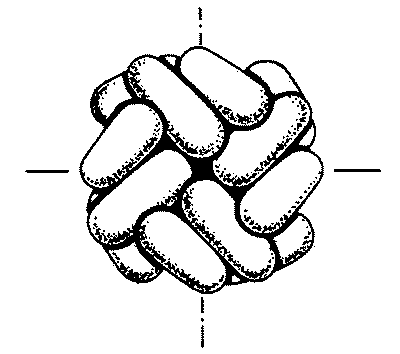
Объединение белковых молекул третичной структуры без появления новых биологических свойств называют агрегированным состоянием.
Биологический смысл появления четвертичной структуры у белков – экономия «генетического материала», поскольку каждая из субъединиц кодируется только одним геномом ДНК. К тому же, в случае появления ошибки при трансляции у одной из субъединиц, отпадает необходимость ресинтеза остальных субъединиц. Четвертичная структура в таком случае распадается на субъединицы, дефектная субъединица удаляется и вновь образуется четвертичная структура с участием нормальной субъединицы. В конце концов, появление ошибки менее вероятно при синтезе (трансляции) сравнительно небольшой полипептидной цепи.
Практически все белки-ферменты имеют четвертичную структуру и состоят, как правило, из четного числа протомеров (двух, четырех, шести, восьми).