Оксидами (в русской химической традиции окислы) называются сложные соединения элемента с кислородом, в которых кислород имеет степень окисления -2.
Почти все химические элементы образуют оксиды, в настоящее время неизвестны оксиды всего трех химических элементов – благородных газов гелия, неона и аргона.
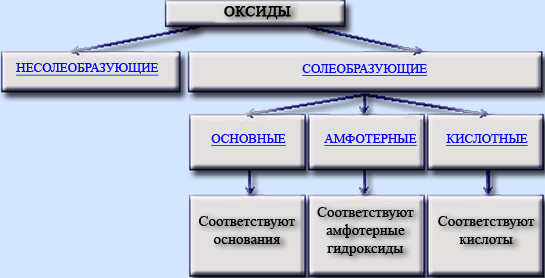
По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие (или безразличные); солеобразующие, в свою очередь, делятся на основные, амфотерные и кислотные.
Несолеобразующие оксиды
Несолеобразующие, или безразличные, оксиды не проявляют ни кислотных, ни основных, ни амфотерных свойств и не образуют соли.
К ним относятся, например, оксид углерода (II) CO, оксид азота (I) N2O, оксид кремния (II) SiO.
Солеобразующие оксиды
Солеобразующие оксиды обладают способностью образовывать кислоты, основания и соли.
К ним относятся, например, оксид серы (IV) SO2, оксид натрия (I) Na2O, оксид алюминия Al2O3.
Амфотерные оксиды
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства, т.е. обладают двойственной природой.
Например, Al2O3 – Al(OH)3 – HAlO2; Cr2O3 – Cr(OH)3 – HCrO2.
Основные оксиды
Основными называются оксиды, которым соответствуют основания, их могут образовывать только металлы.
Например, Na2O – NaOH; CaO – Ca(OH)2; MnO – Mn(OH)2.
Кислотные оксиды
Кислотными называются оксиды, которым соответствуют кислоты, их могут образовывать неметаллы и металлы, проявляющие высокие степени окисления.
Например, SO3 – H2SO4; N2O5 – HNO3; Mn2O7 – HMnO4.