Растворы кислот кислые на вкус, изменяют окраску индикаторов: лакмуса в красный цвет, метилового оранжевого – в розовый, цвет фенолфталеина не изменяется.
В водном растворе растворимые кислоты диссоциируют, образуя ион водорода, и кислотный остаток:
HCl = H+ + Cl-.
Многоосновные кислоты диссоциируют ступенчато:
H2SO4 = H+ + HSO4-,
HSO4- = H+ + SO42-.
Суммарное уравнение:
H2SO4 = 2H+ + SO42-.
- Взаимодействие с металлами
Ca + 2HCl = CaCl2 + H2
Необходимо помнить, что водород из кислот-неокислителей могут вытеснять только металлы, стоящие в электрохимическом ряду напряжений металлов до водорода.
Cu + HCl
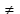 >
>Данная реакция не идет, так как медь стоит в электрохимическом ряду напряжений металлов после водорода.
Некоторые кислородсодержащие кислоты, в которых центральный атом имеет максимальную степень окисления, например, азотная и серная, реагируют с металлами по-другому, потому что в качестве окислителя выступает элемент кислотного остатка, а не водород, серная кислота проявляет окислительные свойства только в концентрированном растворе.
Взаимодействие с металлами
Разбавленная серная кислота не проявляет окислительных свойств, при ее взаимодействии с металлами выделяется водород и соль, содержащая металл в низшей степени окисления. На холоде кислота инертна по отношению к таким металлам, как железо, алюминий и даже барий.
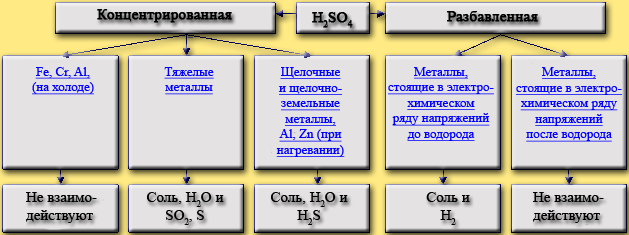
Концентрированная кислота обладает окислительными свойствами. Возможные продукты взаимодействия простых веществ с концентрированной серной кислотой приведены в таблице. Показана зависимость продукта восстановления от концентрации кислоты и степени активности металла: чем активнее металл, тем глубже он восстанавливает сульфат-ион серной кислоты.
Fe, Cr, Al, (на холоде)
Fe + H2SO4 (конц., на холоде)
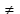
Тяжелые металлы
Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O
Щелочные и щелочно-земельные металлы, Al, Zn (при нагревании)
4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S + 4H2O
Металлы, стоящие в электрохимическом ряду напряжений металлов до водорода
2Al + 3H2SO4 (разб.) = Al2(SO4)3 +3H2
Металлы, стоящие в электрохимическом ряду напряжений металлов после водорода
Cu + H2SO4 (разб.)
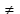
Взаимодействие с металлами.
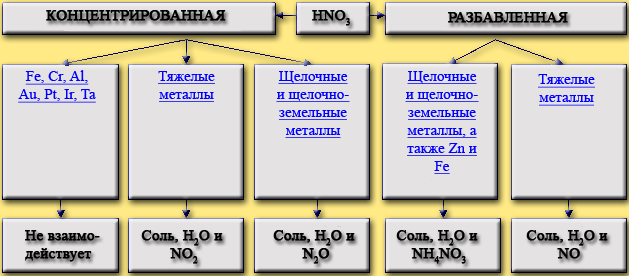
При взаимодействии азотной кислоты с металлами обычно не выделяется водород. В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода. Глубина восстановления нитрат-иона зависит от концентрации кислоты, положения металла в электрохимическом ряду напряжений металлов, степени его измельченности, температуры, то есть от большого количества внешних воздействий, поэтому очень часто образуется не один продукт восстановления, а их смесь.
Возможные продукты взаимодействия простых веществ с азотной кислотой приведены в таблице. Показана зависимость продукта восстановления от концентрации кислоты и степени активности металла: чем активнее металл, тем глубже он восстанавливает нитрат-ион азотной кислоты.
Fe, Cr, Al, Au, Pt, Ir, Ta
Fe + HNO3 (конц.)
Тяжелые металлы
Pb + 4HNO3 (конц.) = Pb(NO3)2 + 2NO2 + 2H2O
Щелочные и щелочно-земельные металлы
4Mg + 10HNO3 (конц.) = 4Mg(NO3)2 + N2O + 5H2O
Щелочные и щелочно-земельные металлы, а также Zn и Fe
4Zn + 10HNO3 (разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Тяжелые металлы
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4H2O
- Взаимодействие с основными оксидами
CaO + 2HCl = CaCl2 + H2O,
CaO + 2H+ = Ca2+ + H2O.
Реакция происходит только в том случае, если образуется растворимая соль.
- Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + 2KOH = K2SO4 + 2H2O,
2H+ + 2OH- = 2H2O,
2HCl + Cu(OH)2 = CuCl2 + 2H2O,
Cu(OH)2 + 2H+ = Cu2+ + 2H2O.
Многоосновные кислоты образуют кислые и средние соли:
H2SO4 + NaOH = NaHSO4 + H2O,
H2SO4 + 2NaOH = Na2SO4 + 2H2O.
- Взаимодействие с солями
Реакции с солями происходят только в том случае, если в результате химического превращения образуется малодиссоциирующее вещество, выделяется газ или выпадает осадок.
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O,
CO32- + 2H+ = CO2 + H2O.
В этом случае выделяется углекислый газ и образуется малодиссоциирующее вещество – вода.
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4,
SiO32- + 2H+ = H2SiO3.
Реакция происходит, так как образуется осадок.
- Специфические свойства кислот
Связаны с окислительно-восстановительными реакциями, бескислородные кислоты в растворе могут только окисляться:
2KMn+7O4 + 16HCl- = Cl20 + 2KCl + 2Mn+2Cl2 + 8H2O,
H2S-2 + Br20 = S0 + 2HBr-.
Кислородсодержащие кислоты могут окисляться (проявлять восстановительные свойства), только когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте:
H2S+4O3 + Cl20 + H2O = H2S+6O4 + 2HCl-.
Если центральный атом находится в максимальной степени окисления, то кислоты проявляют окислительные свойства, например, взаимодействие с металлами и неметаллами:
C0 + 2H2S+6O4 = C+4O2 + 2S+4O2 + 2H2O,
3P0 + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O.