Ртуть – единственный металл, способный образовывать устойчивый двухатомный катион 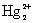 , в котором атомы связаны между собой ковалентной связью –Hg – Hg – . Каждый атом ртути, таким образом, образует две связи, но формально в соединениях
, в котором атомы связаны между собой ковалентной связью –Hg – Hg – . Каждый атом ртути, таким образом, образует две связи, но формально в соединениях 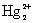 степень окисления ртути принимают равной +1.
степень окисления ртути принимают равной +1.
Для ртути (I) известны черный оксид Hg2O, галогениды Hg2Г2 (где Г – галоген), некоторые соли. Большинство солей нерастворимо в воде, хорошо растворяется только нитрат ртути (I) Hg2(NO3)2, который является основным исходным веществом для получения других соединений ртути (I).
Соединения 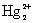 в зависимости от условий проявляют окислительные и восстановительные свойства:
в зависимости от условий проявляют окислительные и восстановительные свойства:
под действием окислителей соединения 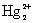 легко переходят в производные Hg2+:
легко переходят в производные Hg2+:
Hg2Cl2 + Cl2 = 2HgCl2;
при воздействии восстановителей соединения 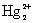 восстанавливаются до металлической ртути:
восстанавливаются до металлической ртути:
Hg2Cl2 + SO2 + 2H2O = H2SO4 + Hg + 2HCl.
Соединения ртути (I) склонны к диспропорционированию с выделением свободной ртути и образованием соединений ртути (II):
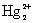 = Hg + Hg2+.
= Hg + Hg2+.
По этой причине невозможно получить по обменным реакциям Hg2S, Hg2(CN)2. Более устойчивы Hg2Cl2, Hg2SO4.
Практическое значение имеет хлорид ртути (I) Hg2Cl2 – каломель. Её получают по обменной реакции:
Hg2(NO3)2 + 2NaCl = Hg2Cl2 + 2NaNO3.
Каломель – белое кристаллическое вещество, в воде не растворяется, плотность 7,15 г/см3, при температуре около 400°С возгоняется.