Задача 1. Запишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Ag  Ag2SO4
Ag2SO4  [Ag(NH3)2]2SO4
[Ag(NH3)2]2SO4  AgCl.
AgCl.
Решение:
Серебро реагирует с концентрированной серной кислотой с образованием сульфата серебра (I), сернистого газа и воды:
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O.
При взаимодействии сульфата серебра (I) с аммиаком образуется сульфат диамминсеребра (I):
Ag2SO4 + 4NH3 = [Ag(NH3)2]2SO4.
Комплексное соединение разрушается при взаимодействии с соляной кислотой:
[Ag(NH3)2]2SO4 + 6HCl = 2AgCl + 4NH4Cl + H2SO4.
Задача 2. Сплав цинка и серебра массой
Дано:
m (Zn + Ag) =
m (осадка) =
M (Zn) = 65 г/моль
M (Ag) = 108 г/моль
M (AgCl) = 143,5 г/моль
Найти:
m (Zn)
m (Ag)
Решение:
Запишем уравнения реакций взаимодействия металлов с концентрированной азотной кислотой:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O, (1)
Ag +2HNO3 = AgNO3 + NO2 + H2O. (2)
После прекращения реакции в растворе остается смесь нитратов серебра и цинка. С раствором хлорида калия будет реагировать только нитрат серебра:
AgNO3 + KCl = AgCl· + KNO3. (3)
Массу серебра вычислим, зная массу образовавшегося хлорида серебра. По уравнению реакции (3) 1 моль хлорида серебра соответствует 1 моль нитрата серебра, а по уравнению реакции (2) 1 моль нитрата серебра соответствует 1 моль серебра, следовательно, соотношение n (Ag) : n (AgCl) = 1 : 1. Вычислим количество вещества хлорида серебра:
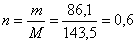 (моль),
(моль),
следовательно, количество вещества серебра равно 0,6 моль. Определим массу серебра:
m (Ag) = n (Ag) · M (Ag) = 0,6 · 108 = 64,8 (г),
тогда масса цинка равна:
m (Zn) = m (сплава) – m (Ag) = 116,8 – 64,8 = 52,0 (г).
Ответ: m (Zn) =