Задача 1. Запишите уравнения реакций взаимодействия между медью и следующими веществами:
а) разбавленным раствором азотной кислоты;
б) концентрированным раствором серной кислоты:
в) концентрированным раствором соляной кислоты.
Решение:
А) Медь растворяется в разбавленной азотной кислоте с образованием нитрата меди (II), оксида азота (II) и воды:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Б) При взаимодействии с концентрированной серной кислотой образуется сульфат меди (II), сернистый газ и вода:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O.
В) С концентрированной соляной кислотой медь реагирует с образованием трихлорокупрата (II) водорода:
Cu + 3HCl = H[CuCl3] + H2.
Задача 2. Вычислите, сколько чистой меди (в кг) можно получить из 500 кг технического оксида меди (I), содержащего 86,4 % Cu2O.
Дано:
m (тех. оксида) =
ω (Cu2O) = 86,4 %
M (Cu) = 64 г/моль
M (Cu2O) = 144 г/моль
Найти:
m (Cu)
Решение:
Запишем уравнение реакции получения меди из оксида меди (I), в качестве восстановителя возьмем угарный газ:
Cu2O + CO = 2Cu + CO2.
Вычислим массу Cu2O, содержащегося в
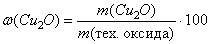 , следовательно,
, следовательно,
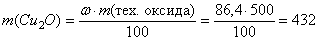 (кг).
(кг).
По уравнению реакции для образования 2 моль меди необходим 1 моль оксида меди (I), то есть соотношение n (Cu2O) : n (Cu) равно 1 : 2. Вычислим количество вещества оксида меди (I):
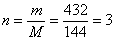 (кмоль).
(кмоль).
Из 3 кмоль оксида меди (I) образуется 6 кмоль меди. Вычислим её массу:
m (Cu) = n (Cu) · M (Cu) = 6 · 64 = 384 (кг).