Задача 1. Запишите уравнения реакций взаимодействия между следующими веществами:
а) цинком и соляной кислотой;
б) магнием и концентрированной серной кислотой;
в) железом и разбавленной азотной кислотой.
Решение:
А) В результате взаимодействия цинка с соляной кислотой образуется хлорид цинка и выделяется водород:
Zn + 2HCl = ZnCl2 + H2.
Б) При взаимодействии магния с концентрированной серной кислотой образуется сульфат магния, вода и продукт восстановления серной кислоты – оксид серы (IV):
Mg + 2H2SO4 = MgSO4 + SO2 + 2H2O.
В) Железо с разбавленной азотной кислотой образует нитрат железа (III) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты, например:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
Задача 2. Смесь кремния, цинка и магния массой
Дано:
m (смеси) =
V1 (H2) =
V2 (H2) =
M (Si) = 28 г/моль
M (Zn) = 65 г/моль
M (Mg) = 24 г/моль
Найти:
ω (Si)
ω (Zn)
ω (Mg)
Решение:
Для решения задачи необходимо знать химические свойства кремния, цинка и магния. С соляной кислотой реагируют только цинк и магний:
Zn + 2HCl = ZnCl2 + H2, (1)
Mg + 2HCl = MgCl2 + H2. (2)
В растворе гидроксида натрия растворяются кремний и цинк:
Si + 2NaOH + H2O = Na2SiO3 + 2H2, (3)
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2. (4)
Обозначим количество цинка в сплаве – х моль, количество магния – у моль, а количество кремния – z моль. Тогда масса цинка будет равна 65х (m = n · M), масса магния – 24у, а масса кремния – 28z. По условию задачи масса смеси равна
65х + 24у + 28z = 31,4.
По уравнению (1) количество вещества цинка, вступившего в реакцию, равно количеству водорода, образовавшегося в результате взаимодействия, тогда объем водорода равен 22,4х (V = n · Vm). По уравнению (2) соотношение n(Mg) : n(H2) равно 1 : 1, тогда объем водорода, выделившегося в этой реакции, равен 22,4y. По условию задачи объем выделившегося водорода в результате взаимодействия с кислотой составляет 11,2 л, поэтому:
22,4х + 22,4у = 11,2.
По уравнению (3) при растворении 1 моль кремния образуется 2 моль водорода, тогда объем водорода равен 2 · 22,4z = 44,8z. По уравнению (4) соотношение n(Zn) : n(H2) равно 1 : 1, тогда объем водорода, выделившегося в этой реакции, равен 22,4x. По условию задачи объем выделившегося водорода в результате взаимодействия со щелочью равен
22,4х + 44,8z = 22,4.
Получили систему трех уравнений с тремя неизвестными:
 |
65х + 24у + 28z = 31,4 |
| 22,4х + 22,4у = 11,2 | |
| 22,4х + 44,8z = 22,4. |
Решив систему уравнений методом подстановки, найдем значение x, равное 0,2 моль; масса цинка составляет:
m (Zn) = n (Zn) · M (Zn) = 0,2 · 65 = 13,0 (г).
y = 0,3 моль, масса магния равна:
m (Mg) = n (Mg) · M (Mg) = 0,3 · 24 = 7,2 (г).
z = 0,4 моль, масса кремния равна:
m (Si) = n (Si) · M (Si) = 0,4 · 28 = 11,2 (г).
Рассчитаем массовые доли компонентов в смеси:
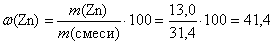 (%);
(%);
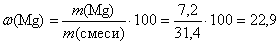 (%);
(%);
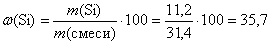 (%).
(%).
Ответ: ω (Zn) = 41,4 %, ω(Mg) = 22,9 %, ω(Si) = 35,7 %.