Степень окисления фосфора равна +5.
Оксид фосфора (V), взаимодействуя с водой, образует метафосфорную кислоту, последняя при кипячении переходит в ортофосфорную, при нагревании ортофосфорной кислоты образуется пирофосфорная кислота.
Метафосфорная кислота HPO3 неустойчива и в чистом виде не выделена, так же как не выделены из растворов её соли. Существует в виде полимеров. Относится к сильным кислотам, ей не свойственны окислительные и восстановительные свойства.
Ортофосфорная кислота
Среди оксокислот фосфора наибольшее значение имеет ортофосфорная кислота Н3РО4, она является наиболее устойчивой из всех кислот фосфора.
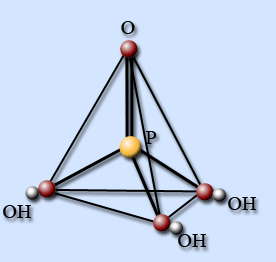
Строение молекулы
В газовой фазе молекула имеет форму тетраэдра с атомом фосфора в центре, в вершинах тетраэдра находятся атом кислорода и три гидроксогруппы. Поэтому фосфорная кислота является трехосновной.
В кристаллическом виде она построена из молекул РО(ОН)3, связанных водородными связями в двухмерные слои. Твердую фосфорную кислоту получить очень сложно: благодаря большому числу водородных связей концентрирование растворов приводит к образованию вязких сиропов, которые кристаллизуются лишь со временем.
Физические свойства
Бесцветные гигроскопичные кристаллы моноклинной сингонии, плотность 1,88 г/см3, температура плавления 42,5 °С. Расплывается на воздухе, смешивается с водой в любых соотношениях. Не ядовита.
Химические свойства
При комнатной температуре довольно инертна, при нагревании проявляет свойства кислот, относится к кислотам средней силы.
- Диссоциация в водном растворе:
Н3РО4 = Н2РО4- + Н+
Н2РО4- = НРО42- + Н+
НРО42- = РО43-+ Н+
Суммарное уравнение:
Н3РО4 = РО43- + 3Н+.
- Свойства кислоты
Реагирует с металлами, стоящими в ряду напряжений металлов до водорода:
3Zn + 2H3PO4 = Zn3(PO4)2 + 3H2.
С оксидами металлов:
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O.
С основаниями:
3Ca(OН)2 + 2H3PO4 = Ca3(PO4)2 + 6Н2О;
Ca(OН)2 + H3PO4 = CaНPO4 + 2Н2О;
Ca(OН)2 + 2H3PO4 = Ca(Н2PO4)2 + 2Н2О.
Не проявляет ни окислительных, ни восстановительных свойств.
Получение
Термический способ получения фосфорной кислоты основан на окислении элементарного фосфора в избытке воздуха с последующей гидратацией и образующегося оксида фосфора (V) и конденсацией фосфорной кислоты:
4Р + 5О2 = Р4О10;
nР4О10 + 2nH2O = 4(HPO3)n при 700 °С,
4(HPO3)n + 2nH2O = 2nH4P2O7 при 450 °С,
2nH4P2O7 + 2nH2O = 4nH3PO4 ниже 230 °С.
Суммарное уравнение:
Р4О10 + 6H2O = 4H3PO4.
Также ортофосфорную кислоту получают при переработке апатитов:
-
Ca5(PO4)3F + 5H2SO4 + 10H2O = 5CaSO4·2H2O + 3H3PO4 + HF.