Строение молекулы
Молекулярная модификация оксида фосфора (V) построена из молекул Р4О10, представляющих собой четыре тетраэдра, соединенных друг с другом общими вершинами. Строение молекулы Р4О10 напоминает структуру Р4О6, только к каждому атому фосфора присоединяется по атому кислорода, связанного с фосфором двойной связью.
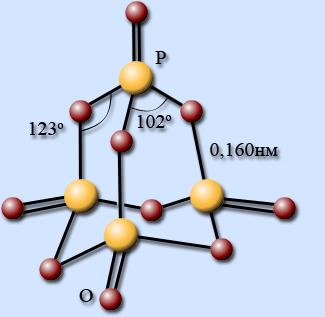
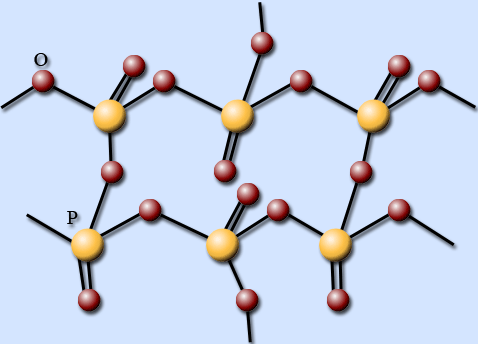
При плавлении некоторые связи в циклических молекулах Р4О10 разрываются, и они превращаются в полимер, состоящий из тетраэдров РО4, объединенных в слои.
Физические свойства
Оксид фосфора (V) – белый рассыпчатый гигроскопичный порошок, рыхлый до пушистости. Расплывается на воздухе, возгоняется при 360 °С.
Химические свойства
- Взаимодействие с водой
Оксид фосфора (V) чрезвычайно жадно присоединяет воду, реакция сопровождается выделением большого количества тепла. При этом образуется смесь фосфорных кислот различного состава, которые при кипячении переходят в ортофосфорную кислоту:
P4O10 + 2H2O = 4HPO3 (метафосфорная кислота),
P4O10 + 4H2O = 2H4P2O7 (пирофосфорная кислота),
P4O10 + 6H2O = 4H3PO4 (ортофосфорная кислота).
- Свойства кислотного оксида
Типичный кислотный оксид:
6CaO + P4O10 = 2Ca3(PO4)2,
6Ca(OH)2 + P4O10 = 2Ca3(PO4)2 + 6H2O.
- Водоотнимающее свойство
Эффективное водоотнимающее средство, способен превращать азотную и серную кислоты в оксиды:
2HNO3 + P2O5 = 2HPO3 + N2O5;
H2SO4 + P2O5 = 2HPO3 + SO3.
Получается при горении фосфора в избытке кислорода:
4Р + 2О5 = Р4О10.