Задача 1. Запишите уравнения реакций взаимодействия между следующими веществами:
а) растворами нитрита натрия и хлорида аммония;
б) золотом и царской водкой.
Решение:
А) При нагревании смеси растворов нитрита натрия и хлорида аммония при 80 °С образуется азот:
NaNO2 + NH4Cl = N2 + 2H2O + NaCl.
Б) Смесь концентрированных азотной и соляной кислот в объемном соотношении 1 : 3 называется «царской водкой», реагирует с золотом согласно уравнению:
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O.
Задача 2. Вычислите массу меди, образующуюся при восстановлении оксида меди (II) аммиаком, полученном при взаимодействии
Дано:
V (N2) =
M (Cu) = 64 г/моль
Найти:
m (Cu)
Решение:
Запишем уравнение реакции восстановления оксида меди (II) аммиаком:
2NH3 + 3CuO = N2 + 3Cu + 3H2O (1)
Аммиак образуется по реакции:
N2 + 3H2 = 2NH3 (2)
Для вычисления массы полученной меди необходимо знать количество образующегося аммиака. По уравнению (2) из 1 моль азота образуется 2 моль аммиака, то есть соотношение n (N2) : n (NH3) = 1 : 2. Вычислим количество азота, вступившего в реакцию:
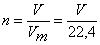 ,
,
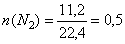 моль,
моль,
следовательно, аммиака образуется 1 моль.
По уравнению реакции (2) 2 моль аммиака соответствует 3 моль меди, то есть соотношение n (NH3) : n (Cu) = 2 : 3, в реакцию вступает 1 моль аммиака, следовательно, образуется 1,5 моль меди. Вычислим массу образующейся меди:
m (Cu) = n (Cu) · M (Cu) = 1,5 · 64 = 96 (г).
Ответ: m (Cu) =