Строение молекулы
Оксид азота (IV) в широком интервале температур существует в виде равновесной смеси мономера NO2 и димера N2O4.
Молекула NO2 имеет угловую форму, предполагается, что атом азота находится в состоянии sp2-гибридизации, длина связи N – O равна 0,119 нм, что соответствует полуторной связи.
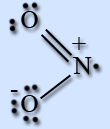
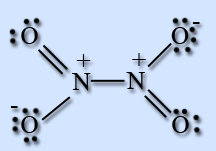
На атоме азота имеется неспаренный электрон, поэтому он легко димеризуется с образованием димера N2O4. Молекула N2O4 плоская и состоит из фрагментов 2ON – NO2 c непрочной связью N – N.
Физические свойства
Оксид азота (IV) NO2 – бурый газ, с резким удушливым запахом, ядовит, N2O4 – бесцветен. Твердый оксид азота (IV) бесцветен и состоит только из молекул N2O4. При его нагревании до температуры плавления -12,8 °С появляется бурая окраска, которая усиливается при повышении температуры и увеличения доли мономера в смеси. Температура кипения 21,5 °С.
Химические свойства
Оксид азота, и мономер, и димер, хорошо растворим в воде, и взаимодействует с ней:
2NO2 + H2O = HNO3 + HNO2,
при этом происходит диспропорционирование на азотную и азотистую кислоты.
При температуре выше 0 °С реакция протекает по другому:
3NO2 + H2O = 2HNO3 + NO.
Если через воду пропускать смесь оксида азота (IV) и воздуха, то образуется только азотная кислота:
4NO2 + 2H2O + О2 = 4HNO3.
Диоксид азота – сильный окислитель, в его атмосфере горят углерод и сера:
С + 2NO2 = CO2 + 2NO;
S + 2NO2 = SO2 + 2NO.
Получение
В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
при термическом разложении высушенных нитратов тяжелых металлов:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
В промышленности окисление оксида азота (II) кислородом:
2NO + O2 = 2NO2,
реакция является обратимой.